德美加三国科学家成功开发基于“超级增强子”的新一代癌症靶向治疗方案
有时候,一些人们引以为傲的优点往往会变成致命的缺点,癌细胞也是这样。
虽然基因突变可以促使癌细胞大军永生、入侵和转移、促进血管生成、雇用正常细胞为其打工等一系列的能力;但与此同时,这也为科学家开发抗癌药物提供了许多理想靶点。
 比如FDA2001年批准的“抗癌神药”格列卫,可以使慢性粒细胞白血病患者的五年生存率从31%提高到了近60%。同时,相比于化疗所自带的“杀敌一千自损八百“buff,格列卫的副作用显著降低,许多患者在服药期间都可以正常的生活(1)。
比如FDA2001年批准的“抗癌神药”格列卫,可以使慢性粒细胞白血病患者的五年生存率从31%提高到了近60%。同时,相比于化疗所自带的“杀敌一千自损八百“buff,格列卫的副作用显著降低,许多患者在服药期间都可以正常的生活(1)。
然而,遗憾的是,并不是所有的癌症患者都这么幸运,可以用上高效低毒的靶向药物。因为,虽然近年来测序技术的发展大大推动了肿瘤的精准治疗,但是对于许多恶性肿瘤而言,科学家并没有找到合适的治疗靶点。
而近日,一项发表在《自然》期刊的重磅研究为癌症靶向治疗开辟了新的方向。来自德国NCT海德堡Hopp儿童癌症中心(KiTZ)、美国俄亥俄州克利夫兰诊所和加拿大多伦多儿童医院的研究人员,通过靶向基因组上的“超级增强子”区域开发出一种全新的癌症靶向治疗方案,并在室管膜瘤中证明了方案的可行性,为癌症患者带来新的希望(2)。
为了更好的理解这一研究,我们首先需要简单了解一下增强子以及超级增强子。
简单说,增强子就是基因组上的一段DNA序列,可以与转录因子相互配合调控基因的表达。例如,HeLa细胞中编码β球蛋白基因上游的增强子,可以使β球蛋白基因的表达增强200倍(3)。
同时,据统计,人类细胞中编码蛋白质的基因只有25000个,而增强子却有近百万个。也就是说,之所以我们人类所有细胞的基因组都是一样的,但细胞的形态和功能却不同,很大程度上是由增强子决定的。
 而在增强子的基础上,2013年Richard A.Young教授又提出了超级增强子的概念。当时,Young教授在研究小鼠胚胎干细胞时,意外的发现,胚胎干细胞多能性的维持,主要受少数几个转录因子和相应的增强子配合。相比于普通的增强子,这些增强子促进基因表达能力更强,是普通增强子的近4倍;同时,这些增强子主要负责调控决定细胞身份的基因表达,比如决定癌细胞身份的致癌基因(4)。因此,Young教授把这些增强子命名为超级增强子。
而在增强子的基础上,2013年Richard A.Young教授又提出了超级增强子的概念。当时,Young教授在研究小鼠胚胎干细胞时,意外的发现,胚胎干细胞多能性的维持,主要受少数几个转录因子和相应的增强子配合。相比于普通的增强子,这些增强子促进基因表达能力更强,是普通增强子的近4倍;同时,这些增强子主要负责调控决定细胞身份的基因表达,比如决定癌细胞身份的致癌基因(4)。因此,Young教授把这些增强子命名为超级增强子。
但是超级增强子和癌症又有什么关系呢?
随后一些学者发现,大部分超级增强子在细胞内处于抑制状态,不同的细胞内,只有少量决定细胞身份的超级增强子被打开。而一旦细胞内哪怕一个超级增强子打开错误,或靶向错误的基因就足以导致肿瘤的发生(5,6)。
不仅如此,人们还发现,许多肿瘤细胞关键致癌基因都是由超级增强子驱动的。同时,与正常细胞相比,在肿瘤发生过程中肿瘤细胞还会主动在致癌基因处构建超级增强子用以驱动致癌基因的表达(7)。
显然,相比于单个的基因或分子,肿瘤细胞或许更依赖于超级增强子的活性。这也意味着,超级增强子是一个更加理想的抗癌靶点。
 为了验证靶向超级增强子治疗癌症的可行性,研究人员开始了本次实验。
为了验证靶向超级增强子治疗癌症的可行性,研究人员开始了本次实验。
首先,研究人员按照严格的筛选标准找到了42名包含了各种不同亚型室管膜瘤患者进行实验,来寻找可以作为靶点的超级增强子,并验证靶向超级增强子治疗癌症的可行性。因为室管膜瘤是一种对化疗耐药,目前也没有靶向治疗方案的恶性脑癌(8)。
通过联合免疫沉淀结合高通量测序技术(ChIP-seq),全外显子测序(WES),全基因组测序(WGS),转录组分析,DNA复制数分析以及DNA甲基化数据,研究人员最终从42名患者的癌细胞中找到了近1700种癌细胞依赖的超级增强子,以及与之相关的致癌基因。
通过与目前已知的标准超级增强子数据库进行对比,研究人员发现,这些超级增强子都具有显著的肿瘤特异性,主要在肿瘤细胞中被激活,其中一些超级增强子还在其他类型的癌症中起作用。
随后,为了确定这些超级增强子对癌细胞的重要程度。研究人员构建了一系列的小分子干扰RNA,逐个抑制这些超级增强子的功能,最后确定了15个室管膜瘤癌细胞最依赖的超级增强子,缺少这15个超级增强子中的任意一个,癌细胞的生存能力下降至少50%。同时,在这1700个超级增强子中,有60%都是癌细胞所依赖的。这进一步证明了,超级增强子是理想的抗癌靶点。
最后,研究人员通过将自己的实验数据与华盛顿大学药物与基因作用数据库进行比对,找到了一种小分子物质,可以特异性抑制超级增强子对于室管膜瘤细胞内关键致癌基因,CACNA1H基因的增强作用。同时,在室管膜瘤小鼠体内,研究人员发现,这种小分子物质可以使室管膜瘤小鼠生存期延长40%,并且几乎不会影响正常组织细胞存活。
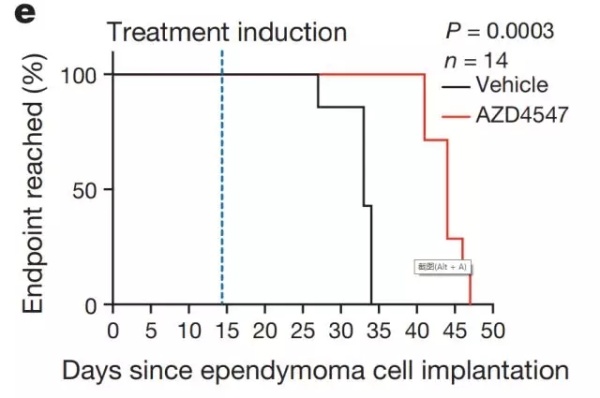 抑制超级增强子可以延长室管膜瘤小鼠生存期
抑制超级增强子可以延长室管膜瘤小鼠生存期
显然,这一实验表明,靶向超级增强子对于癌症的治疗是可行的。正如本文通讯作者之一,德国NCT海德堡Hopp儿童癌症中心(KiTZ)项目负责人Kristian Pajtler教授所说,“我们发现了调控室管膜瘤发展的全新通路,通过使用特定的药物抑制这一通路,我们可以减缓癌细胞的生长速度,最终诱导癌细胞凋亡(9)”。这也为室管膜瘤以及其他缺乏良好药物治疗方法的恶性肿瘤提供了全新的治疗方案。
参考资料:
1.Kantarjian H M, Shah N P, Cortes J E, et al. Dasatinib or imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (DASISION)[J]. Blood, 2012, 119(5): 1123-1129.
2.Mack S C, Pajtler K W, Chavez L, et al. Therapeutic targeting of ependymoma as informed by oncogenic enhancer profiling[J]. Nature, 2017.
3.Banerji J, Rusconi S, Schaffner W. Expression of a β-globin gene is enhanced by remote SV40 DNA sequences[J]. Cell, 1981, 27(2): 299-308.
4.Whyte W A, Orlando D A, Hnisz D, et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes[J]. Cell, 2013, 153(2): 307-319.
5.Dowen J M, Fan Z P, Hnisz D, et al. Control of cell identity genes occurs in insulated neighborhoods in mammalian chromosomes[J]. Cell, 2014, 159(2): 374-387.
6.Gröschel S, Sanders M A, Hoogenboezem R, et al. A single oncogenic enhancer rearrangement causes concomitant EVI1 and GATA2 deregulation in leukemia[J]. Cell, 2014, 157(2): 369-381.
7.Lovén J, Hoke H A, Lin C Y, et al. Selective inhibition of tumor oncogenes by disruption of super-enhancers[J]. Cell, 2013, 153(2): 320-334.
8.Pajtler K W, Witt H, Sill M, et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups[J]. Cancer cell, 2015, 27(5): 728-743.
9.https://www.sciencedaily.com/releases/2017/12/171220131715.htm
文章来源:奇点网


{replyUser1} 回复 {replyUser2}:{content}