巨噬细胞“协助”癌症在超早期转移
传统的观念中,癌症转移往往发生在病情中晚期,早期转移相当少见,因此及早清除原发癌灶就能实现治愈。但2016年《自然》上的两篇论文却显示,癌细胞完全可以在肿瘤尚未成型,只能靠电子显微镜观察到的超早期就离开原发部位,转移到人体各处,这简直想想都让人头皮发炸……治愈癌症的结论,谁还敢轻易做出呢?
虽说癌细胞神通广大,但想成功“冲出亚马逊”早早转移,帮手肯定少不了。新年刚过的《自然通讯》上,西奈山伊坎医学院的研究团队就把帮凶之一揪了出来:巨噬细胞会和癌细胞沆瀣一气,促进癌细胞的这种超早期转移。巨噬细胞帮起癌症来,为什么这么熟练啊?
水无常势,兵无常形,巨噬细胞里面也少不了拖后腿帮倒忙的家伙
要说巨噬细胞帮助癌细胞,倒不是什么新鲜事,毕竟现在连“肿瘤相关性巨噬细胞”的大帽子都有了,不过此前的观点普遍认为,得在癌细胞初步发展形成肿瘤之后,巨噬细胞才会被癌细胞拉拢,促进癌症的进一步增殖和转移。
 但由Julio A. Aguirre-Ghiso教授领衔的研究团队却觉得可能并非如此。早在2016年在《自然》上发表乳腺癌的超早期转移研究时,他们就对转移的癌细胞进行了基因测序,发现在基因水平上,它们和坚守原处的癌细胞并无多少差异。转移这条路并不好走,一路上要遭遇各种艰难险阻,只有约0.01%的癌细胞能成功转移,这些超早期的癌细胞既然没有脱胎换骨,哪来的底气大胆单飞?恐怕有贵人相助。
但由Julio A. Aguirre-Ghiso教授领衔的研究团队却觉得可能并非如此。早在2016年在《自然》上发表乳腺癌的超早期转移研究时,他们就对转移的癌细胞进行了基因测序,发现在基因水平上,它们和坚守原处的癌细胞并无多少差异。转移这条路并不好走,一路上要遭遇各种艰难险阻,只有约0.01%的癌细胞能成功转移,这些超早期的癌细胞既然没有脱胎换骨,哪来的底气大胆单飞?恐怕有贵人相助。
说到癌细胞的贵人,科学家们自然会想到肿瘤微环境。微环境中的许多细胞都是癌细胞拉拢的对象,正常细胞被拉下水还不算完,它们还能在癌细胞的指导下主动自我改造,更好地效忠新主子,巨噬细胞就是这些意志不坚定分子中的一员,而且还与乳腺的正常发育和乳腺癌的肺转移关系密切。也许它们其实来的更早一些,还操纵了乳腺癌的超早期转移?
肿瘤微环境也算是群英荟萃,细胞开会了
口说无凭,捉贼还得拿赃。借助乳腺癌小鼠模型,研究团队开始对巨噬细胞“送一程”的假说进行验证,发现在癌症仍处于“电镜观察期”的超早期,巨噬细胞就已经围绕到了癌症部位,在巨噬细胞的影响下,癌细胞的钙粘附蛋白E(E-cadherin)表达水平明显下调,这意味着它们的侵袭和转移能力大幅增强。
巨噬细胞到底在癌症的超早期转移中作用有多大呢?借助单克隆抗体,研究人员选择性清除了聚集在癌症周围的巨噬细胞,发现血液中检测到的循环肿瘤细胞(CTCs)数目立刻就锐减了七成,各处器官出现的转移癌细胞数目也显著减少,而且这些细胞也没有通过被巨噬细胞吞噬的方式暗度陈仓,是实打实的丧失了转移能力!
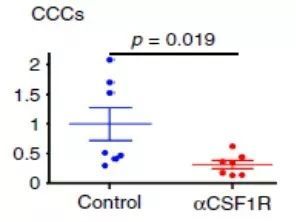 研究中使用的单抗并不会影响肿瘤的继续生长,因此循环肿瘤细胞数量上的巨大差异基本可以客观反映癌细胞的转移能力强弱
研究中使用的单抗并不会影响肿瘤的继续生长,因此循环肿瘤细胞数量上的巨大差异基本可以客观反映癌细胞的转移能力强弱
进一步的分析显示,巨噬细胞的“热心帮忙”与乳腺癌细胞早期分泌的趋化因子CCL2有关,这也与此前研究揭示的巨噬细胞激活机制吻合。不过研究团队也发现,早期清除巨噬细胞只是对癌症转移的“缓兵之计”,并不能完全阻止,但清除也可以拖延肿瘤增大后的下一波转移。
虽说从发现巨噬细胞的共犯性质到开发出针对性的治疗手段,还要经历一个不短的过程,但不可否认,“清除早期癌症原发灶=治愈”的观念看来又要被进一步动摇了。当癌症直接不玩广积粮缓称王的老套路时,作为对手的我们又该怎么出招呢?
参考资料:
1.Hüsemann Y, Geigl J B, Schubert F, et al. Systemic spread is an early step in breast cancer[J]. Cancer cell, 2008, 13(1): 58-68.
2.Harper K L, Sosa M S, Entenberg D, et al. Mechanism of early dissemination and metastasis in Her2+ mammary cancer[J]. Nature, 2016, 540(7634): 588-592.
3.Hosseini H, Obradović M M S, Hoffmann M, et al. Early dissemination seeds metastasis in breast cancer[J]. Nature, 2016, 540(7634): 552-558.
4.Linde N, Casanova-Acebes M, Sosa M S, et al. Macrophages orchestrate breast cancer early dissemination and metastasis[J]. Nature Communications, 2018, 9(1): 21.
5.Nabet B Y, Qiu Y, Shabason J E, et al. Exosome RNA unshielding couples stromal activation to pattern recognition receptor signaling in cancer[J]. Cell, 2017, 170(2): 352-366. e13.
6.Qian B Z, Li J, Zhang H, et al. CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J]. Nature, 2011, 475(7355): 222-225.
7.https://www.reuters.com/article/us-health-metastasis-breast-cancer/immune-cells-linked-to-very-early-spread-of-breast-cancer-idUSKBN1ER1F3
文章来源:奇点网


{replyUser1} 回复 {replyUser2}:{content}