Nature:解析出真核生物寡糖转移酶的三维结构
在一项新的研究中,来自美国文安德尔研究所的研究人员揭示出一种用于修饰蛋白的分子复合物的原子结构,这可能为开发治疗癌症和许多其他疾病的新药铺平道路。相关研究结果于2018年1月22日在线发表Nature期刊上,论文标题为“The atomic structure of a eukaryotic oligosaccharyltransferase complex”。
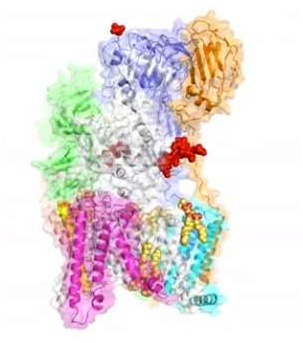 图片来自Nature, doi:10.1038/nature25755
图片来自Nature, doi:10.1038/nature25755
这种被称作寡糖转移酶(oligosaccharyltransferase, OST)的复合物在蛋白糖基化中发挥着关键的作用,其中蛋白糖基化是一种广泛存在的细胞过程,与人体中的众多功能密切相关。它的作用是添加一种被称作聚糖的糖分子到蛋白上,影响这些蛋白的形状,从而影响它们的功能。
论文通信作者、文安德尔研究所教授Huilin Li博士说,“解析出OST的原子结构是糖生物学的一大突破。作为N-连接聚糖生物合成通路中的一种关键酶,OST在健康和疾病中都发挥着重要的作用。我们希望这些发现将导致人们开发出治疗癌症和许多其他疾病的改变生活的药物。”
大多数由OST修饰的蛋白是分泌到细胞外的或嵌入在细胞表面膜中,在那里它们充当细胞与它的环境之间的联系渠道。比如,它们暴露于细胞周围环境中和聚糖的存在让它们成为开发新药物的理想靶标,其中这些新药物通常利用聚糖的特定化学特征来消灭癌细胞。
尽管OST在数十年前就已被发现,但它的结构仍不清楚。在这项新的研究中,这些研究人员解析出来自面包酵母(一种简单而优雅的生物医学研究模型)的OST的原子结构。
与通过蛋白相互作用组装的其他复合物不同,构成OST的八种膜蛋白在很大程度上是由位于它的结构中心的七个磷脂分子“粘合”在一起。这些脂质使得这种复合物难以纯化用于结构分析。
论文第一作者、Li实验室高级研究员Lin Bai博士说,“OST结构的复杂性和新颖性是非常显著的。这种结构是十多年研究的结果,为一种常见的影响人体中的一半蛋白的细胞过程提供了重要的清楚说明和深刻理解。”
这种结构提示着它的八种组分蛋白所发挥的功能性作用,这些蛋白是经过数十亿年的进化而被招募到这个催化性核心酶上。这些研究人员发现其中的一些蛋白识别供体底物(donor substrate)聚糖或受体蛋白(acceptor protein),而剩下的蛋白协调蛋白合成和蛋白转运复合物---这些过程对维持生命是至关重要的。
这种结构也揭示出可能利用旨在校正癌症等疾病中的功能障碍的药物加以靶向作用的关键反应位点。
OST是文安德尔研究所利用最先进的大卫-文安德尔高级低温电显镜套件(David Van Andel Advanced Cryo-Electron Microscopy Suite)成功进行成像观察的第三个分子。
参考资料:
Lin Bai, Tong Wang, Gongpu Zhao et al. The atomic structure of a eukaryotic oligosaccharyltransferase complex. Nature, Published online: 22 January 2018, doi:10.1038/nature25755
文章来源:生物谷


{replyUser1} 回复 {replyUser2}:{content}