Science:揭示β-桶蛋白插入到线粒体膜中的机制
在一项新的研究中,来自德国弗莱堡大学的研究人员成功地描述了所谓的β-桶蛋白(beta-barrel protein)是如何被插入到线粒体膜中的。这些蛋白让线粒体能够输入和输出分子。基于这一发现,由Nils Wiedemann教授和Nikolaus Pfanner教授领导的研究团队与Carola Hunte教授博士领导的研究团队合作,阐明了蛋白生物化学中的一个基本问题。相关研究结果发表在2018年1月19日的Science期刊上,论文标题为“Membrane protein insertion through a mitochondrial β-barrel gate”。
 图片来自Christophe Wirth
图片来自Christophe Wirth
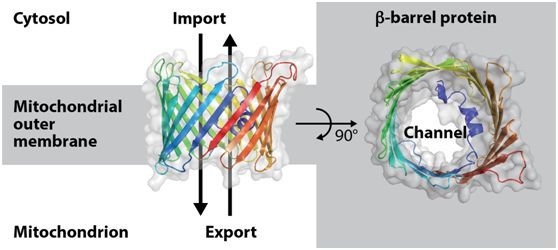
给细胞提供能量的线粒体含有大约1000个从胞质溶胶中转运而来的蛋白分子。为此,它们的外膜具有由具有桶状结构的分子(即所谓的β-桶蛋白)组成的蛋白输入通道。在线粒体中,来自营养物的能量被用于产生细胞能量分子三磷酸腺苷(ATP)。ATP通过线粒体外膜上的桶孔(barrel pore)被运输到胞质溶胶中,从而给人细胞提供燃料。
大约30年前,由弗赖堡大学Georg Schulz教授领导的研究团队报告了β-桶蛋白的结构:在相反方向上延伸的蛋白链形成片层,这些片层通过将蛋白的第一条链和蛋白的最后一条链连接在一起形成一种中空的圆柱体结构。自那时以来,科学家们一直想要知道这类通道形成蛋白分子是如何被插入到生物膜中的。随后,人们在线粒体外膜中鉴定出分选与组装复合体(sorting and assembling machinery, SAM),这种复合体是β-桶蛋白插入到线粒体膜中所必需的。
Sam50是用于形成β-桶蛋白的SAM的中央亚基的名称。这是当前的这项研究的起始点。 Alexandra Höhr博士通过实验证实新合成的β-桶蛋白的最后一条链被导入在Sam50的β-桶结构的第一条链和最后一条链之间,而Sam50的β-桶结构也是这种β-桶蛋白插入到线粒体膜中的起始位置。她和Caroline Lindau一起证实新合成的β-桶蛋白的新生链逐个地被装入到Sam50的侧面开口,一直到完整的β-桶蛋白被释放到线粒体膜中。
鉴于线粒体和具有光合能力的叶绿体都来源于相同的细菌祖先,因此这项新的研究不仅有助于更好地理解线粒体的形成和功能,而且为叶绿体和细菌的形成提供了新的见解。
参考资料:Alexandra I. C. Höhr, Caroline Lindau, Christophe Wirth et al. Membrane protein insertion through a mitochondrial β-barrel gate. Science, 19 Jan 2018, 359(6373):eaah6834, doi:10.1126/science.aah6834
文章来源:生物谷


{replyUser1} 回复 {replyUser2}:{content}