中国已在基因治疗领域领先美国,下一个千亿市场正处爆发前夜
近年来,以CRISPR-Cas9为代表的基因编辑技术为生命医学带来革命性变化,人们对基因编辑、基因治疗等新技术寄予厚望,期待在临床治疗方面大放异彩、攻克顽疾难症。
2018年1月,美国宣布将在未来6年出资1.9亿美元,支持体细胞基因编辑研究,以开发安全有效的基因编辑工具,治疗更多人类疾病。美国不惜重金发展基因编辑技术,显然对该技术十分看好。
近两年,中国在精准医疗领域政策发布也非常密集,对基因编辑等技术给予大量支持。比如将精准医疗上升为国家战略,计划在2030年投入600亿元。2017 年 4 月印发《“十三五”生物技术创新专项规划》,点明发展“新一代基因操作技术”。
具体要发展精确或定量化的新型基因操作技术,真核生物细胞的基因(组)编辑技术,在工业生产和环境保护等方面具重要应用价值的新型微生物基因重组技术,促进多种基因(组)编辑手段的融合,重视基因操作的效率和通量,提高易操作性,降低脱靶性,扩大应用范围。
据中商产业研究院最新报告,2016至2020年全球精准医疗市场规模将以每年15%的速率增长。预计 2020 年全球精准医疗市场规模将破千亿,达到 1050 亿美元,“基因剪刀”将是撬动千亿级大市场的一把钥匙。
新一代CRISPR技术
目前基因编辑作为精准医疗的分支,产业链并不完整,更多是技术的突破与更新迭代。新的基因组编辑技术,如 ZFNs(锌指核酸酶)、TALENs(转录激活因子效应物核酸酶)和CRISPR-Cas9 系统的相继出现给基因治疗领域开辟了新途径。由于它们能操作简单、定向精准且成本较低地编辑靶向位点,避免了传统依赖同源重组、有效率低、耗时复杂等弊端,正成为新一代基因治疗的宠儿。
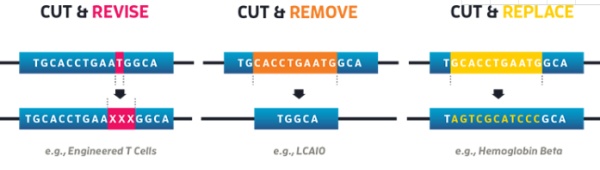 上图显示CRISPR工作的三种模式
上图显示CRISPR工作的三种模式
 上图显示基因编辑治疗的大致流程
上图显示基因编辑治疗的大致流程
研究成果也不断证实基因编辑在临床治疗中的美好前景,如TALEN靶向治疗杜氏肌营养不良(DMD)、ZFN治疗帕金森(PD)、TALEN或ZEN都有望治疗大疱性表皮松解疾病和α1-抗胰蛋白酶缺陷症、TALEN或CRISPR-Cas9治疗镰刀型细胞贫血症、CRISPR-Cas9治疗遗传酪氨酸血症、白内障等等。
而CRISPR技术相比前两代基因编辑技术,ZFN和TALEN,对特定DNA的定位更加精准,成本更低廉,有助于基因疗法走向大众。据了解,每进行一次ZFN基因编辑。仅采购锌指就花费5000美元,而第三代CRISPR/Cas9技术,只需订购一段向导RNA,大概花费30美元,显然更节约成本。
咨询公司BCG调查显示,基于基因编辑开发的专利技术在过去5年呈井喷式增长,2010~ 2014年增长率高达41%。其中CRISPR技术发展最为迅速,TALEN和ZFN稍微落后,专利主体有科研机构也有企业,表明技术已经从单纯学术研究向商业化应用转化并迅速推广。
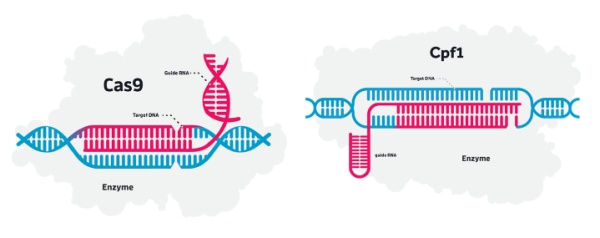
2017年除CRISPR-Cas9外,基因编辑体系更加完善,一些新的改进技术映入眼帘,不仅提高编辑效率,降低脱靶效应,也更加安全。CRISPR-Cpf1基因编辑系统就是新一代基因工具,Cpf1也称作Cas12a,比Cas9系统更简单,且蛋白酶更小,更易传送至细胞内,最后切割位点更精确。基于诸多优点,科研人员肯定将围绕CRISPR-Cpf1展开更多研究。除了编辑DNA,一种可靶向编辑RNA的CRISPR-Cas13工具也被发现,可在哺乳动物细胞中发挥作用,另外关于Cas9的改良也不在少数,目的是让基因编辑更准确和安全。
 全球发展如火如荼
全球发展如火如荼
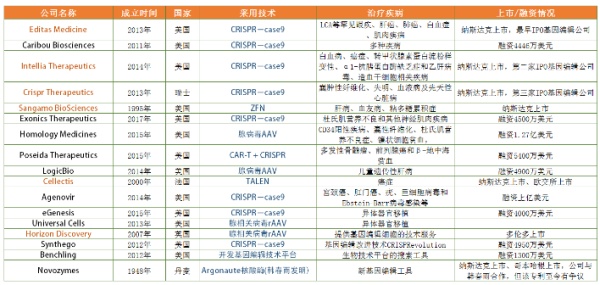
贝壳社梳理了国外基因编辑相关企业(如下表),从表中能看出17家公司中有6家已经上市,且大多总部设在美国,可见美国在基因编辑技术领域仍走在前列。各家所采用的技术也几乎涵盖了三代编辑技术,但仍以CRISPR为主,另外腺病毒或腺相关病毒技术也较为普遍,其次CAR-T联合CRISPR技术的出现,表明联合治疗法将成为一种新趋势。最后,河北科技大学的韩春雨副教授声称发现一种不同于CRISPR的新核酸酶Argonaute,虽然引发全球关注,也吸引丹麦诺维信谋求合作,但该发现至今未被认可,甚至疑为学术造假。
 以下介绍重点公司:
以下介绍重点公司:
Caribou Biosciences,2011年10月成立的美国公司,致力于将CRISPR-Cas9技术应用在基因治疗、农业生物技术、生物研究和工业生物技术等四大领域。其公司联合创始人Jennifer Doudna是基因编辑的大牛,公司高管也曾任职于杜邦、孟山都等著名农业生物科技公司。Caribou Biosciences目前共获得4446万美元融资,诺华制药也是众多投资者之一。
Intellia Therapeutics成立于2014年11月,由Caribou Biosciences和Atlas Venture联合创办。2016年5月,Intellia Therapeutics成功在纳斯达克IPO。Intellia Therapeutics主要关注体内疗法,例如转甲状腺素蛋白淀粉样变性、α1-抗胰蛋白酶缺乏症和乙肝病毒;体外疗法,例如血液干细胞移植和CARTs等。诺华当初也领投了Intellia Therapeutics的A轮,随后与其建立广泛合作,将CAR-T技术与CRISPR-Cas9基因组编辑技术相融合,开发新的癌症疗法,研究镰状细胞病、β-地中海贫血等造血干细胞相关疾病。
Editas Medicine由风云人物张锋等创办,也是最早IPO的基因编辑公司。2015年与CAR-T巨头Juno Therapeutics开展独家合作,涉及良性血液疾病、遗传性肌肉疾病、遗传性肺病、遗传性和感染性肝病等研究。Editas Medicine曾获得比尔盖茨、谷歌等投资,该公司最先进的技术是莱伯先天性黑蒙式10治疗方案(LCA10)。
CRISPR Therapeutics是第三家美股上市的基因编辑公司,总部位于瑞士,在美国做研发,在英国伦敦开展业务。CRISPR Therapeutics与拜耳、Vertex制药公司建立战略合作,开发亟需药物。CRISPR Therapeutics专注于将CRISPR-Cas9技术临床应用于囊肿性纤维化、失明、血液病及先天性心脏病等领域。
Sangamo成立于1995年,2017年公司进行了人体临床试验,包括首次体内人类基因组编辑研究,主要有四项临床试验,分别评估血友病A、血友病B、MPS I和MPS II(粘多糖累积症I型和II型)治疗的安全性和耐受性,其中血友病A是与辉瑞公司开展独家全球合作。与上述公司不同,Sangamo采用ZFN基因编辑技术。据报道,2016年9月,Sangamo BioSciences血友病B基因疗法SB-FIX获FDA授予的孤儿药资格。
eGenesis,由29岁北大才女杨璐菡和她的导师在2015年联合创办。杨璐菡此前在《科学》杂志上发表论文,介绍一种新的基因编辑技术,能清除猪基因组中可能有害的病毒基因,为猪器官移植人体破除关键障碍。据悉,eGenesis首先通过基因编辑技术消除猪基因组内的内源病毒(PERV),解决异种移植的首要安全隐患;其次选定若干重要免疫节点,并优化节点,以解决猪和人的免疫不兼容性。该技术一旦真正成熟,巨大的商业价值不容小觑。
中国成美国强劲对手
虽然美国基因编辑水平位于世界前列,但中国在该领域的技术同样世界领先,美媒甚至称“中国基因编辑技术发展令美国望尘莫及”。2018年1月23日媒体报道,杭州肿瘤医院院长兼肿瘤医生吴式琇从去年3月起,就尝试用CRISPR-Cas9技术治疗食道癌患者。
中国作为全球第一个将CRISPR用于人体试验的国家,迄今至少有86名中国患者接受了基因编辑治疗。而美国之所以丧失领先优势的主要原因是美国监管更严,需要通过种种风险评估与安全检查,在尽可能保证患者安全的前提下,才能实施基因编辑治疗。毫无疑问,中国将成为美国基因编辑技术的强劲对手。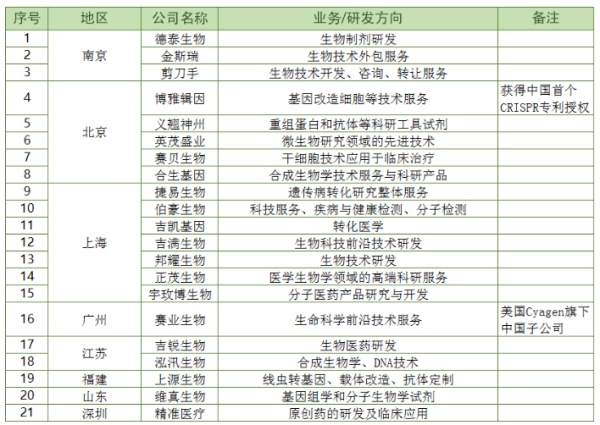 不完全统计,中国涉及基因编辑的企业有21家,大多数以技术支持和服务外包为主,客户来源医疗机构、企业、科研院所与高校等,可见基因编辑技术本身在国内发展较为成熟,接受度较高。
不完全统计,中国涉及基因编辑的企业有21家,大多数以技术支持和服务外包为主,客户来源医疗机构、企业、科研院所与高校等,可见基因编辑技术本身在国内发展较为成熟,接受度较高。
分析未来基因编辑发展趋势,首先基因编辑技术与CAR-T联合,有望成为免疫治疗的突破口。2015年,曾报道基因编辑结合CAR-T技术,成功挽救1名白血病孩子的生命。其中就使用了由Cellectis公司生产的经TALEN编辑后的T细胞;而作为CAR-T最早的实践者,诺华也频频投资CRISPR基因编辑公司并与之合作,也是希望能在肿瘤治疗领域有所突破,比如解决异体T细胞表面抗原引起的排异反应,让经改造的细胞回输毫无障碍就是目标之一,心愿一旦达成,CAR-T的商业化难题将随之解决。
其次,中国为占领基因编辑技术制高点,在政策监管方面较为宽松,为技术发展提供足够空间。2016年7月,四川华西医院伦理委员会批准了卢铀团队的临床试验研究,成为全球首例CRISPR临床试验。当时卢铀表示,该研究仅仅是评价治疗安全性,至于是否有效或广泛可应用于临床,还难以确定。可见,在政策支持下,中国医疗机构有机会实施更多临床试验,证实安全性和有效性后,有望率先推出基因编辑的癌症治疗方案。
实际上,基因编辑技术目前仍在不断探索、改造和升级当中,很难说如今的任何一种基因编辑技术已完全成熟。CRISPR系统最早发现于细菌当中,2018年1月30日《科学》杂志刊文称,科学家又发现了超10种的细菌免疫机制,它们都是富有潜力的分子工具。当研究机制更深入透彻,将可能替代CRISPR,成为更可靠好用的工具。所以未来基因编辑技术还将不断推陈出新,带给人类更多惊喜。
文章来源:健康界


{replyUser1} 回复 {replyUser2}:{content}