《科学》:研究首次证实用患者癌组织培育的“迷你肿瘤”,可预测抗癌药物疗效,灵敏度达100%
2018 年 1 月 3 日,自然旗下的子刊 Nature method 以封面文章的形式发表社论,公布了 2017 年生命科学领域最有潜力的“年度技术”[1]。
让人感到不可思议的是,它既不是荣膺诺贝尔化学奖的冷冻电镜,也不是红遍大江南北的 CRISPR,而是“名不见经传”的类器官(organoids)。
而就在社论发表后不久,来自英国伦敦癌症研究所的 Nicola Valeri 博士就在 Science 上发表了最新研究,给了类器官一记完美助攻 [2]。
Valeri 博士带领的研究团队,通过对 71 名已经出现转移并且经历了多种治疗方案的晚期结肠癌和胃食道癌患者进行临床实验,首次证明,类器官可以准确预测抗癌药物对患者的疗效。具体来说,如果一种抗癌药物对于该患者的肿瘤类器官无效,那么这种药物 100% 对于该患者无效。反过来,如果一种药物对于该患者的肿瘤类器官有效,那么这种药物有近 90% 的可能性对于该患者是有效的。
Valeri 博士
对此,英国癌症研究院首席临床医师 Charles Swanton 教授表示:“对于医生来说,一般很难准确快速预测化疗对于单个癌症患者的治疗效果,而这种新方法甚至可以帮助我们准确预测靶向治疗的效果 [3]。”
说到这里,我们可能需要简单介绍一下类器官。
近年来,许多科学家陆续发现,通过将不同组织来源的干细胞,放入 3D 培养基中,小心地调整培养刺激方案,可以制造出多种与人类器官,如眼睛、肠、肝、肾、胰腺、前列腺、肺、胃等类似的 3D 细胞团。
这些细胞结构虽然不是真正意义上的人类器官,但能在结构和功能上模拟真实器官,在人类器官发育研究、疾病机制研究、药物筛选和器官修复材料等方面均有重要作用。因此,这些微型人造器官获得一个统一名称:类器官(organoids)[4]。
看到这里,许多读者可能还是没有感受到类器官的厉害之处。
2010 年,纽约哥伦比亚大学器官移植专家 Takanori Takebe 培养出了肝脏类器官。他知道许多患者因为肝脏衰竭而死,他希望利用组织工程技术解决这个难题。
当他将 12 个人类来源的肝脏类器官接种到小鼠腹部仅 2 天后,这些“人造肝脏”就在小鼠体内自动搭建了血管联系和血液供应,同时这些细胞继续发育成成熟肝脏细胞,能制造肝脏特异性蛋白,能代谢药物。用药物将小鼠自身肝脏破坏后 1 月内,大多数对照组动物死亡,但接受肝脏类器官移植的动物却大多存活了下来 [5]。
人体来源的小肠类器官
相比于正常器官,肿瘤组织的类器官则起步较晚,直到 2014 年,才由纪念斯隆凯特林癌症中心领导的一项研究,首次建立了前列腺肿瘤的类器官,这些前列腺肿瘤类器官的组织结构与它们起源的转移灶样本高度相似。对转移灶样本和匹配的类器官进行测序显示,每个类器官与它们起源的患者肿瘤组织的基因表达完全一致 [6]。
这无疑为研究人员提供了一个令人兴奋的新工具来测试癌症药物和个体化的癌症疗法。毕竟,相比于 2D 细胞培养物以及动物模型,人体来源的类器官,由于与其来源组织的生理结构和功能保持高度一致性,且可以快速构建,这在抗癌药物的筛选以及癌症精准医疗上,显然更胜一筹。当然,这还需要临床实验的验证。
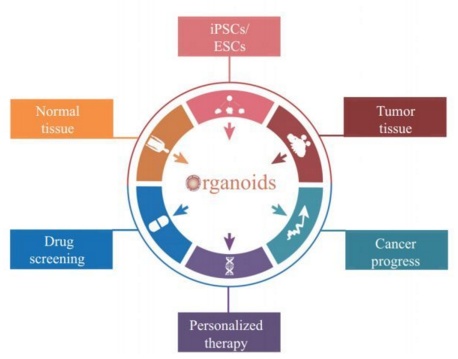
类器官在肿瘤研究中的应用
为此,Valeri 博士开始了本次实验。在 2014-2017 年间,Valeri 博士共招募了 71 位转移性结肠癌和胃食道癌患者,提取了 110 份新鲜肿瘤组织并培养成类器官,共进行了 4 个前瞻性的临床实验,测试了 55 种已经进入临床的或者正在进行临床实验的抗癌药物。
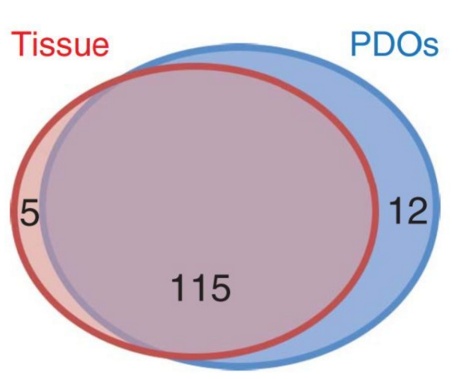
通过对这些类器官以及相对应的患者的肿瘤组织进行组织形态分析以及基因表达分析,Valeri 博士发现,这些类器官无论是组织形态,还是基因表达模式,都与其来源肿瘤组织保持高度一致性。并且,这种一致性在使用药物治疗的过程中同样存在。这意味着,类器官的确与其来源肿瘤组织具有高度的相似性。
类器官与其来源肿瘤组织有 96% 的突变谱重叠
随后,Valeri 博士便开始验证,类器官作为药物筛选工具是否可行。
通过对药物库中 55 种正在进行 1 - 3 期临床试验或者已经上市的抗癌药物,进行 3 维筛选,并与患者服药数据进行对比,结果发现,无论是靶向药物,还是化疗药物,类器官都可以准确预测抗癌药物是否对患者有效。
总体而言,类器官在预测抗癌药物的有效性上,具有 100% 的敏感性,93% 的特异性,88% 的阳性预测值以及 100% 的阴性预测值。也就是说,如果一种药物在该患者的类器官上起作用,那么这种药物就有 88% 的可能性在患者身上起作用;而如果一种药物对该患者的类器官无效,那么这种药物 100% 对该患者无效。
对此,Valeri 博士表示,“以前试图预测患者对治疗的反应如何,基本上是通过小鼠模型实现的。但是,尽快得到答案以便通知治疗一直是挑战。毕竟当人们使用小鼠模型时,至少需要六到八个月的时间才能得出结果。而现在,有了类器官,我们可以在几周甚至更快的时间内获得结果 [3]。”
基于此实验数据,Valeri 博士还表示,“类器官模型应该被纳入临床实验的患者招募程序,这样癌症患者才有希望找到能拯救自己的药物,才能活得更久 [7]。”
参考资料:
1.https://www.nature.com/articles/nmeth.4575
2.Vlachogiannis G, Hedayat S, Vatsiou A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers[J]. Science, 2018, 359(6378): 920-926.
3.https://www.bbc.co.uk/news/amp/health-43154878?__twitter_impression=true
4.Fatehullah A, Tan S H, Barker N. Organoids as an in vitro model of human development and disease[J]. Nature cell biology, 2016, 18(3): 246.
5.Takebe T, Zhang R R, Koike H, et al. Generation of a vascularized and functional human liver from an iPSC-derived organ bud transplant[J]. Nature protocols, 2014, 9(2): 396.
6.Gao D, Vela I, Sboner A, et al. Organoid cultures derived from patients with advanced prostate cancer[J]. Cell, 2014, 159(1): 176-187.
7.https://www.the-scientist.com/?articles.view/articleNo/51874/title/Tumor-Organoids-Predict-How-Well-Patients-Respond-to-Cancer-Drugs/
文章来源:生物360




{replyUser1} 回复 {replyUser2}:{content}