各国罕见病药物政策解读
罕见病是指那些发病率极低的疾病,大多是慢性、退行性疾病,会导至残疾等非常严重的后果,甚至危及生命。然而,全球患者都面临着诊断率低、缺医少药等巨大困境。其实罕见病并不罕见,目前全球有3.5亿罕见病患者,中国患者可能超过1600万。目前中国在罕见病药物的研发和相关国家政策的制定上还落后于欧美国家。
 2018年2月28日是第十一届国际罕见病日,本文对罕见病药物的各国政策进行较为全面的介绍。
2018年2月28日是第十一届国际罕见病日,本文对罕见病药物的各国政策进行较为全面的介绍。
罕见病包括遗传病、癌症、传染性热带病和退行性疾病等,罕见病药物是指用于治疗、预防或诊断罕见病的药物或疫苗。
各国法律对罕见疾病的定义不尽相同,但一般与疾病的患病率、严重程度和是否有治疗方法相关。比如在美国,罕见病指全国患者人数不到20万例的疾病,即每10000人中仅不到6.4人患有此病;而在欧盟(EU),罕见病被定义为患病率小于5/10000且威胁生命或造成长期痛苦的疾病。目前估计有6000~8000种罕见疾病,影响着全球约6%~8%的人口。
同一种病在各国的治疗费用差别很大。根据2007年的估算,在德国一个囊性纤维化病人的终生治疗成本估计为858,604欧元,而在美国2006年估算的治疗费用为1,907,384欧元。
虽然罕见病不罕见,但真正有效的药物却“罕见”,仅有不到十分之一的罕见病患者能够获得相应的治疗。罕见病药物的研发对于减少罕见病的患病率和死亡率非常重要,但由于罕见疾病药物市场小、潜在利润低,而研发成本高,所以药厂缺乏研发动力。
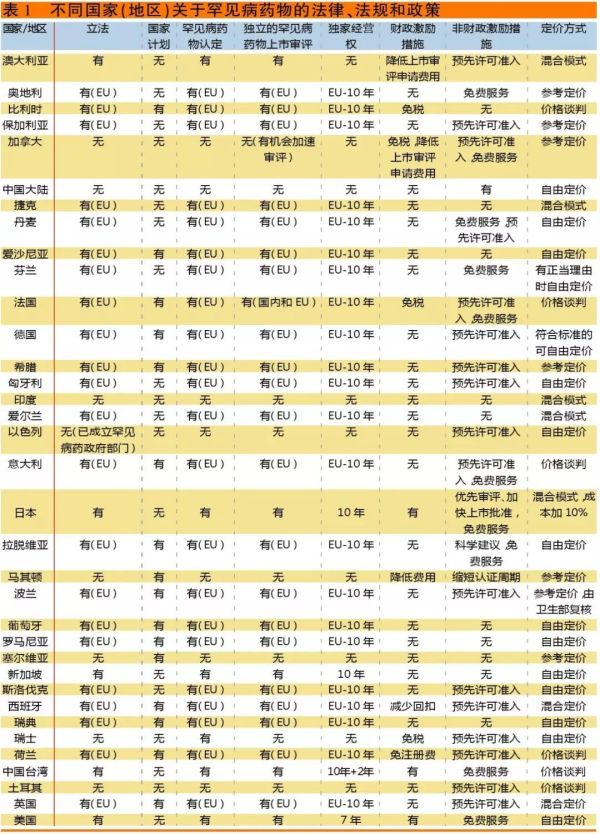
不过,目前许多国家制定了法律法规,鼓励罕见病药物的研发,为药品的上市、定价和报销提供帮助,并作为重要的公共卫生决策。影响罕见病药物可获得性和可及性的主要因素包括国家法律法规、罕见病药物认定、罕见病药物审评政策、独家经营权、激励措施、定价和报销政策,表1和表2概括了全球各个国家罕见病药物的相关政策。笔者归纳并分析八类罕见病药物政策,以飨读者。

立法——
罕见病药物法规
一些国家和地区为鼓励罕见病药物的研发和销售制定了相应的法律法规。1983年,美国通过了《罕见病药物法案》(Orphan Drug Act),成为第一个为罕见病药物立法的国家。日本是第二个,于1993年立法。1997年,澳大利亚对其1990年版《医疗用品法》(Therapeutic Goods Act)进行了全面修订,增加了罕见病药物相关政策。2000年,针对罕见病药物的欧盟立法(CE(第141/2000号条例))得以实施。
中国台湾“卫生署”在1999年即成立“罕见疾病立法小组”,同年提出《罕见疾病法草案》和《罕见疾病药物法》提案。2000年开始施行《罕见疾病防治及药物法》,这是全球第5个罕见病药物法规。台湾将罕见病定义为年患病率万分之一以下的疾病,目前已颁布《罕见疾病防治及药物法施行细则》《罕见疾病医疗补助办法》《罕见疾病药物认定申请要点》《罕见疾病药物查验登记审查准则》《罕见疾病药物专案申请办法》《罕见疾病药物供应制造及研究发展奖励办法》等法规政策。
罕见病药物立法旨在应对由于罕见疾病市场规模较小而导至产品开发成本过高以及利润潜力差的挑战。立法包括各种鼓励罕见病药物研发和销售的激励措施。这些措施通常包括:罕见病药物病研发费用的税收抵免、授予多年的市场独占权、控制仿制药或新药上市、提供免费的研发咨询(如协助设计试验方案),以及对获得罕见病药认定的新药进行快速审评、优先审查,或批准预先许可准入(包括超适应症使用和未正式上市之前的“同情性使用”)。
值得注意的是,患者的倡议大大促进了罕见病药物的立法。例如美国的国家罕见病组织(NORD)和欧洲罕见疾病组织(EURODIS),这些团体一方面通过传播相关知识提高患者获得罕见病药物和相应治疗的机会,另一方面还游说第三方支付者或政府拨款的医疗机构为药物提供全额报销。
国家罕见疾病计划
国家罕见疾病计划的总体目标是建立一个为罕见病病人提供服务、信息、治疗,激励罕见疾病药物的研发以及正确指导患者组织开展倡议活动的监管框架。
国家罕见疾病计划与罕见病药物立法不同,因为他们往往没有将具体的制度落实到位。大多数情况下,它们表明了国家在罕见病药物和罕见病领域的立场。例如,保加利亚、希腊、马其顿、罗马尼亚和塞尔维亚等5个欧洲国家已经制定了国家罕见疾病计划。但这些计划在药物可获得性(罕见病药物认可和市场许可)和可及性(降低药价和提高报销比例)方面发挥的作用,会受到国家购买力、财政预算以及定价和报销制度标准的影响。
跨境权利——
欧盟跨境治疗管理
欧盟是唯一一个在整个成员国实施统一的罕见病药物认定和上市批准的国际团体。在欧盟,跨境管理尤为重要,否则患者会因为本国罕见病药物的购买渠道少、专业医师和医疗机构的经验不足而失去医治的机会。
欧盟第2011/24号法令规定了患者具有跨境治病的权利。按照这个法令,如果一个国家的卫生保健系统不能在合理的时间内为本国的罕见病患者提供必要的治疗,那么患者有权到欧盟其它成员国治病。
不过,由于欧盟不同国家对这类药物的定价和报销政策的不同,因而不同国家的患者获得罕见病药物的机会有所差异。
特殊标签——
罕见病药物认定
罕见病认定的基础是疾病严重(威胁生命或长期折磨病人)和医疗需求未被满足(没有疗效显着的药品和其他治疗),同时考虑疾病的患病率或药物经济指标。患病率标准每个国家不同,经济指标主要考虑药品的预期销售额能否超过研发成本。由于可纳入临床试验的患者数量少,因此罕见病药物临床证据的“质”和“量”比较低。
治疗非罕见疾病的药物,如果获得罕见病药物认定,可按罕见病药物获得上市许可。在美国,罕见病药物中抗癌药物的数量最多,占所有罕见病药物的32.5%,欧洲、日本和澳大利亚的情况也类似。
独立上市政策——
针对罕见病的上市审评政策
对罕见病药物采用特殊的上市审评政策对于促进罕见病药物的可获得性至关重要。
在非欧盟国家,罕见病药物上市审评程序与非罕见病药物通常是相同的。例如,在澳大利亚、美国和日本两者大致相同。对于目前没有罕见病药物立法的国家,如加拿大和以色列,两者程序也是一样。
但是在欧盟,两者的审评程序有所不同。在欧盟,罕见病药物认定由欧洲药品管理局罕见病药品委员会(COMP)进行,而罕见病药物上市和非罕见病药物一样,都由人类用药委员会(CHMP)批准。在每个成员国新药的上市都由CHMP批准,确保了每个成员国病人能够享有获得罕见病药物的平等权利。
澳大利亚、加拿大、英国、法国、德国、匈牙利、荷兰、波兰、斯洛伐克、瑞士和美国执行类似的罕见病药物上市审评标准。在塞尔维亚和马其顿,如果某个药物已经在其它较大的国家获得上市批准,那么这两个国家的审评程序就会简化。此外,小国家的患者及时获得罕见病药物可能受到影响,因为制药公司往往会先在美国或欧盟申请上市。
各个国家往往依据相同的临床研究数据来评估罕见病药物的临床有效性,也通常使用相同的标准来认定罕见病药物,包括适应症的严重程度和未满足的医疗需求。但各国对研究结果的解释往往存在差异,这可能会影响上市的进程。
据报道,在欧盟罕见病药物立法以来的前十年(2000-2010年),罕见病药物认定后获得上市的成功率约为10.9%。美国的成功率与其相似,自1983年《罕见病药物法》实施以来的28年,成功率平均为15.9%。成功率低可能是由于罕见病药物认定的标准远比新药上市审评标准低。这也反应出对罕见病药物的激励措施促进了罕见病药物的认定申请;但同时上市批准的标准越来越严格。
快速上市通道——
非专有通道,但罕见病更易获得资格
为了确保能及时向市场供应罕见病药物,一些国家加快了上市审评程序。这些程序包括:优先审评、快速通道和加快上市批准。
虽然这个程序同时适用于罕见病药物和非罕见病药物,但通常非罕见病药物只有针对缺乏治疗方法和严重的疾病,而且疗效非常显着才能获得加速审评资格;而罕见病药物更容易申请到这些程序。例如,用于治疗肺动脉高压的罕见病药物伊洛前列素(iloprost)于2004年12月在美国得到优先审查资格,正常的审评周期为10个月,而它在6个月内即收到审评结论。加速评估通常只需要标准上市许可流程所需时间的一半左右(美国约150天,正常需一年或更长)。
研发激励——
财政激励、预先许可准入
财政和非财政支持两种激励措施,用于促进罕见病药物的研发。
在全球范围内实施的财政激励措施包括:科研资助、税收减免、营销专有权和审评费免除。这些规定是为了让制药公司赚回研发成本,因为罕见病药物的市场规模很小,可能收不回成本。据统计,国外90%的罕见病药物临床试验获得财政支持。
非财政措施包括:快速审评、预先许可准入(以同情性使用的形式或超适应症使用)和提供免费服务,如协助试验方案的设计和研发。法国、意大利、西班牙和荷兰允许对罕见病药物实施预先许可准入。预先准入许可制度允许进口那些已在其他国家获上市批准但是本国未获上市许可的罕见病药物。在许多国家,预先许可准入通常是病人获得罕见病药物最常用的方法。虽然可以获得预先许可准入,但病人往往要自费购买。
独家经营权即给予制药公司一定的市场独占期。在市场独占期,监管机构不批准仿制药或其它新药上市。然而,根据美国和欧洲的罕见病药物政策,如果罕见病药物供应不足、利润足够高或其它药物的临床疗效优于现有罕见病药物,那么该药的独家经营期限可能会被撤销。但迄今为止,欧盟和美国没有撤回任何药物的市场独占地位,即便它们的利润在不断上涨。
独家经营权是推动全球罕见病药物发展的强大动力,但罕见病药物市场的垄断和制药商的高标价正引发担忧。因为很多罕见病几乎没有其它可替代的疗法,形成了基于垄断的定价方式。基于垄断的定价方式可能会影响患者获得罕见病药物,因为政府或保险机构面临医疗费用上涨的压力。
文章来源:小桔灯网


{replyUser1} 回复 {replyUser2}:{content}