盘点靶向癌症中的表观遗传变化
前言
在过去的几年中,得益于二代测序技术的发展,人们发现在癌症中表观遗传调控基因的突变是非常常见的。因此靶向表观遗传的疗法得到了长足的发展,包括针对功能获得基因突变(gain-of-function)的化学小分子抑制剂,以及利用“协同致死(synthetic lethality)手段来应对那些传统手段无法靶向的功能缺失基因突变(loss-of-function)。在这里,小编通过最近的几篇综述,给大家介绍下表观遗传药物发现和开发的最新进展。
癌症中的表观遗传突变
遗传和表观遗传的变化,以及环境等因素,都会影响到人类健康与疾病发生。表观遗传学研究的是那些不属于DNA中序列改变的可遗传性状。在过去的几年中,人们发现在肿瘤中,编码表观遗传修饰调控蛋白的基因突变非常常见。其中一些突变驱动了肿瘤起始,另外的突变则影响了细胞生长,免疫入侵,转移,异质性以及耐药性。因此,靶向表观遗传突变成为了一项非常具有潜力的肿瘤疗法。
在人类肿瘤中,表观遗传突变主要发生在四大类:DNA 甲基化酶,染色质重塑因子复合物,组蛋白修饰酶,组蛋白修饰识别蛋白与组蛋白。此外,其他的一些突变,包括一些代谢酶,也会影响表观遗传酶的功能。
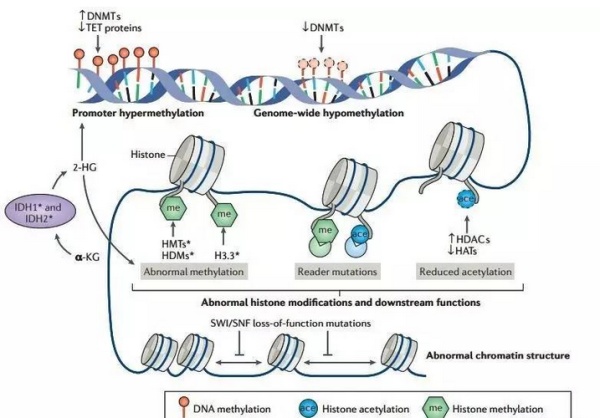 癌症中的表观遗传突变。癌症中的表观遗传突变会导致:1. DNA启动子区域过度甲基化,从而导致一些抑癌基因的沉默;2. 基金组范围内的DNA低甲基化,引起基因组的不稳定;3. 异常的组蛋白修饰和识别蛋白的结合,会影响转录,DNA复制和修复以及细胞周期等过程;4. 异常的染色质结构,也会影响转录,DNA复制和修复以及细胞周期等过程。
癌症中的表观遗传突变。癌症中的表观遗传突变会导致:1. DNA启动子区域过度甲基化,从而导致一些抑癌基因的沉默;2. 基金组范围内的DNA低甲基化,引起基因组的不稳定;3. 异常的组蛋白修饰和识别蛋白的结合,会影响转录,DNA复制和修复以及细胞周期等过程;4. 异常的染色质结构,也会影响转录,DNA复制和修复以及细胞周期等过程。
靶向功能获得(gain-of-function)的表观遗传突变
DNMT抑制剂
在白血病,肺癌,乳腺癌,胃癌和结直肠癌等多种肿瘤中,都发现了DNA甲基转移酶(DNMT)表达上调,同时抑癌基因P15,P16,MLH1和RB等基因启动子区域过度甲基化。因此DNMT抑制剂能够降低这些抑癌基因启动子甲基化水平,从而使这些被异常沉默的抑癌基因重新激活,发挥功能。
目前主要有两种DNMT抑制剂:核苷类似物(能够组装进DNA从而将DNMTs限制在DNA上)以及非核苷类似物(直接结合DNMTs的催化结构域)。目前,已有两种DNMT抑制剂阿扎胞苷(azacitidine)和地西他滨(decitabine)被FDA批准用于骨髓增生异常综合征(MDS)的治疗。它们两个都属于核苷类似物,目前正在进行多项临床临床试验用于治疗白血病和其他实体瘤。此外,还有多种DNMT抑制剂处于开发之中。尽管非核苷类似物不会组装进DNA,其毒性较弱,但是其缺乏足够的效能和特异性,因此现在还未广泛的进行临床试验。
DNMT抑制剂的主要问题在于其特异性和细胞毒性。DNMT抑制剂能够降低整个基因组水平的DNA甲基化程度,因而可能会带来一些有害的影响。同时它们也会影响正常细胞DNA合成从而导致DNA损伤。而且在实体瘤中,单一的DNMT抑制剂缺乏疗效。因此在临床实验中,低剂量的DNMT抑制剂被用来使癌细胞变得更加敏感,它在与放疗,化疗以及免疫疗法的联用中表现出了良好的效果。
HDAC抑制剂
组蛋白乙酰化能够中和赖氨酸残基上的正电,降低组蛋白与DNA之间的静电作用,从而形成开放的染色质状态,转录因子也更容易结合到DNA上。细胞内的乙酰化的调控主要通过两种酶来实现:乙酰基转移酶(Histone acetyltransferases,HAT)和组蛋白去乙酰化酶(Histonedeacetylases,HDAC)。在前列腺癌,胃癌,结直肠癌和宫颈癌等多种癌症中发现,HDACs表达上调且组蛋白乙酰化水平发生了改变。
小编之前文章《表观遗传与肿瘤治疗:HDAC抑制剂类药物研究报告》已经详细盘点了HDAC抑制剂的研发状况,现有六个产品已经上市:Vorinostat(SAHA),Panobinost -at,Mocetinostat,Romidepsin,Belinostat和西达本胺。其中西达本胺是由中国微芯研发的1.1类新药,2014年获CFDA批准上市用于外周T淋巴细胞瘤的治疗。
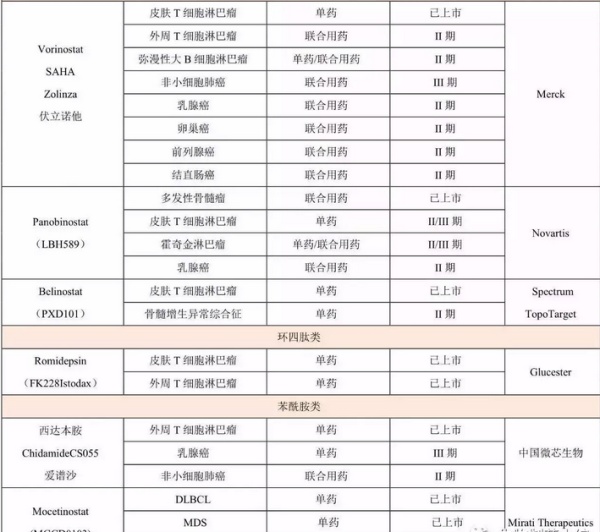 已上市的HDAC抑制剂
已上市的HDAC抑制剂
现在有14种不同的HDAC抑制剂在多达130个临床试验中用于治疗血液瘤和实体瘤。然而由于有18种HDACs,且这些酶能同时催化组蛋白与非组蛋白的去乙酰化,因此对于HADC抑制剂的选择性以及作用机理还缺乏更深入的了解。此外,还有30多个临床试验显示,由于HADC抑制剂的稳定性以及剂量限制,HADC抑制剂在作为单药治疗实体瘤时缺乏足够的疗效。因此HADC抑制剂正在与DNMT抑制剂以及免疫检查点抑制剂联用。
HMT抑制剂
与组蛋白乙酰化不同,不同位点的组蛋白甲基化对于转录的激活与抑制有着不同影响。其中H3K4与H3K36的甲基化被认为与转录激活相关,而H3K9与H3K29的甲基化与转录抑制相关。人体内有60多种组蛋白甲基转移酶(HMT),每种HMT只负责一到二个残基的甲基化,且每个HMT对应着特定的单甲基化,双甲基化,三甲基化水平。因此,与DNMT抑制剂和HADC抑制剂相比,靶向HMTs有着更好的特异性与更低的细胞毒性。
目前,EZH2(H3K27甲基转移酶)抑制剂和DOT1L(H3K79)抑制剂正处于临床试验阶段。EZH2是负责H3K27甲基化的PRC2复合物的催化亚基。在多种实体瘤中发现了EZH2的过表达,且在15-20%的滤泡性淋巴瘤和弥漫大B细胞淋巴瘤中也发现了EZH2基因的功能获得性突变(主要影响了SET催化结构域的Y641)。EZH2抑制剂能够降低基因组H3K27me3水平,重新激活相关抑癌基因的表达,从而抑制EZH2过表达癌细胞的生长。有四个EZH2抑制剂正在临床试验之中,它们是GSK126, EPZ-6438 (tazemetostat), CPI-1205和DS-3201b。其中最近Epizyme报道了EPZ-6438 (tazemetostat)积极的二期临床结果:在EZH2突变的滤泡性淋巴瘤(FL)患者中,tazemetostat产生了92%的应答率;在野生EZH2 FL患者中应答率为26%;在EZH2突变的弥漫大B细胞瘤(DLBCL)中应答率为29%。
EZH2抑制剂的相关信息
DOT1L曾被认为是H3K79唯一的甲基转移酶,直到最近的报道揭示了NSD2也能催化H3K79甲基化。研究显示,DOT1L对于携带MLL基因易位的白血病细胞的增殖和存活是必要的。MLL融合蛋白能够招募DOT1L到MLL的下游基因上,引起H3K79甲基化水平升高,从而导致成白血病驱动基因HOXA9和MEIS1等异常表达。目前DOT1L抑制剂EPZ-5676正处于临床试验,用于治疗复发的/难治的携带MLL基因重排的白血病。
除了EZH2和DOT1L之外,其它的组蛋白甲基转移酶(HMT)的抑制剂也正处于开发阶段。比如H3K9me和H3K9me2 HMT蛋白G9a(EHMT2)的抑制剂BIX-01294,E72和A-366;还有H3K4 HMT蛋白SMYD2的抑制剂LLY-507和BAY-598。希望这些抑制剂能在以后带来令人兴奋的结果。
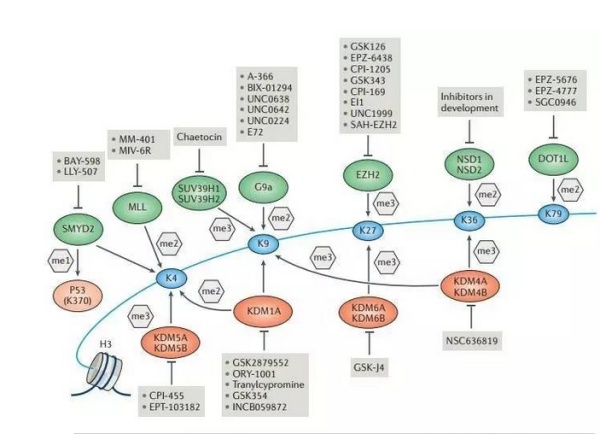 靶向HMTs和HDMs功能获得性突变或者过表达的药物
靶向HMTs和HDMs功能获得性突变或者过表达的药物
HDM抑制剂
人组蛋白去甲基化酶(HDM)根据其活性位点可以分为两个亚家族:KDM1亚家族(2个成员)和JMJC亚家族(约30个成员)。然而由于JMJC亚家族成员催化活性结构域的保守性,获得其高选择性的抑制剂是个非常大的挑战。因此目前只有四个KDM1A抑制剂处于临床试验之中:GSK2879552,tranylcypromine,INCB059872和ORY-1001。
KDM1A能够催化H3K4me,H3K4me2和H3K9me的去甲基化。在卵巢癌,肝癌,肺癌和乳腺癌等多种肿瘤中发现KDM1A基因表达量都显著上调。KDM1A的上调表现出了很差的预后,导致了细胞周期调节基因的上调与免疫反应相关基因的下调。研究显示,一些biomarker能够指导KDM1A抑制剂的使用,如tranylcypromine能优先引起MLL-AF9基因融合的白血病细胞的凋亡,GSK2879552更倾向于抑制高DNA甲基化水平的肺癌细胞生长。
BET抑制剂
Bromodomain蛋白能够结合乙酰化的组蛋白赖氨酸残基,从而介导下游的染色质重塑,转录调控等过程。BET家族包括BRD2, BRD3, BRD4和BRDT。BET的致癌性最早在NUT中线癌中被发现,BRD3或BRD4基因易位融合NUTM1,上调MYC基因表达从而阻止上皮细胞分化,促进其增殖。目前TEN-010正处于临床试验治疗NUT中线癌,AML和MDS。
虽然BET基因易位在别得癌症中不常见,但是BET抑制剂能够抑制淋巴瘤,AML多发性骨髓瘤,前列腺癌,乳腺癌,胰腺癌,卵巢癌和非小细胞肺癌等癌症的生长。目前多种BET抑制剂正处于临床实验中,包括GSK525762,OTX015(MK-8628),CPI-0610,ABBV-075,ZEN003694,BMS-986158,GS-5829,PLX51107,FT-1101和INCB054329等。OTX015和CPI-0610在血液瘤中都展现出了令人鼓舞的数据。
IDH抑制剂
异柠檬酸脱氢酶IDH1(细胞质)和IDH2(线粒体)的突变发生在20%的急性髓细胞白血病AML病人,50-80%的神经胶质瘤病人,以及软骨肉瘤,甲状腺癌等多种实体瘤中。突变的IDH1/IDH2导致了致癌代谢物2-羟基戊二酸2-HG的积聚,而2-HG能够抑制α-KG依赖的去甲基化酶活性,从而导致DNA的高甲基化水平与mTOR通路的激活。
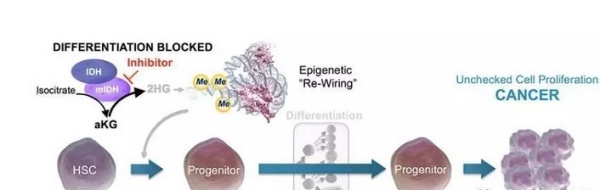 IDH突变的致病机理
IDH突变的致病机理
在IDH抑制剂方面,Agios公司处于领先地位。其AG-120和AG-221分别是突变IDH1和IDH2的抑制剂。AG-120和AG-221均获得了FDA颁发的孤儿药认定与快速通道资格。临床结果显示,对于携带IDH1和IDH2突变的急性髓细胞白血病AML病人,AG-120和AG-221的缓解率分别达到了33%和41%。这两款新药可能在今年递交NDA申请。此外IDH1和IDH2共抑制剂AG-881也在开发中。希望这些新药能够尽快上市给AML病人带来福音。
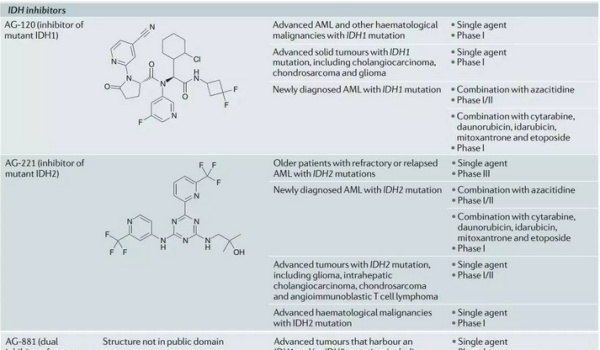 IDH抑制剂的相关信息
IDH抑制剂的相关信息
靶向功能缺失的表观遗传突变
一些表观修饰基因可能是传统的抑癌基因,其功能缺失突变会导致肿瘤的发生。然而这些突变无法用常规的方法所靶向,而最近异常火爆的协同致死(synthetic lethality)为治疗这样的功能缺失突变提供了可能。协同致死是指单一的基因突变对于细胞活性没有太大影响,而当两个基因同时缺失时,会导致细胞死亡。目前FDA只批准了一组基于协同致死效应的疗法:PARP1抑制剂用于治疗BRCA1或BRCA2缺陷的卵巢癌。希望在CRIPSR等技术的加持下,对于功能缺失的表观遗传突变,也能开发出有效的疗法。
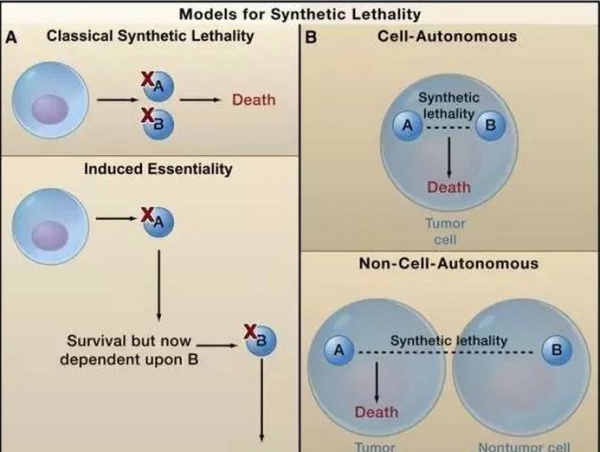 协同致死的原理
协同致死的原理
SWI/SNF缺陷与EZH2抑制
SWI/SNF染色质重塑因子复合物包含12-15个蛋白成员,它们能够通过移动核小体从而调控基因转录,DNA复制和修复等生物过程。SWI/SNF家族蛋白的缺失突变在人类癌症中相当普遍,能达到20%。目前,研究已经发现了一些关于SWI/SNF缺陷的协同致死效应。
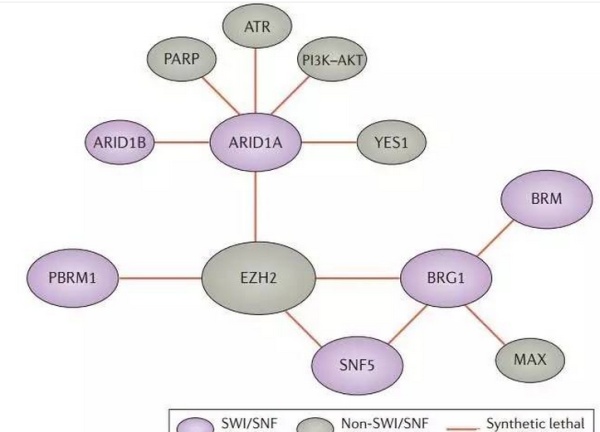 有SWI/SNF成员参与的协同致死网络
有SWI/SNF成员参与的协同致死网络
其中一项非常有前景的临床试验是EZH2抑制剂EPZ-6438,用于治疗SNF5阴性的肿瘤,目前正处于二期临床。SNF5是SWI/SNF的成员,具有转录共激活活性。在杆状肿瘤,上皮肉瘤,小细胞肝胚细胞瘤以及未分化的肉瘤中,都发现了SNF5的缺失。在这些SNF5缺失的肿瘤中,EZH2表达量都上调了,且驱动了抑癌基因P16的沉默。EZH2抑制剂能够重新激活P16的表达,同时抑制SNF5缺失癌细胞的增殖。
除SNF5之外,其它的SWI/SNF成员基因,包括ARIA1A,PBRM1和BRG1都与EZH2表现出了协同致死效应。对于EZH2抑制剂EPZ-7210,它能够杀死BRG1缺陷的卵巢癌细胞,但是不能够杀死BRG1缺陷的肺癌或者ARID1A缺陷的卵巢癌细胞,因此需要更多的研究,如何将这些协同致死效应转化为治疗手段。
其他SWI/SNF成员相关的协同致死
SWI/SNF成员之间也存在协同致死效应,比如SNF5与BRG1,BRG1和BRM。此外,ARID1A是SWI/SNF中最常突变的成员,在超过50%的卵巢透明细胞癌,19%的胃癌,19%的膀胱癌,14%的肝细胞癌,12%的黑色素瘤和其他肿瘤类型中都存在ARID1A功能缺失突变。因此ARID1A是一个潜在的广谱抗癌靶点。目前,研究发现ARID1A与EZH2,ARID1B,PARP,ATR,PI3K-AKT存在协同致死效应。
H3K36me3缺失与细胞检查点抑制
在10-25%的肾癌,膀胱癌,子宫癌,卵巢癌,肺癌,胃癌,胰腺癌和神经胶质瘤中,都发现了H3K36me3的缺失,H3K36me3的缺失可能是由甲基转移酶SETD2的失活,去甲基化酶KDM4A和KDM4B的过表达,或者H3.3的突变(K36M,G34R或G34V)造成的。最近的研究发现H3K36me3的缺失与细胞周期检查点相关基因存在协同致死效应。WEE1抑制剂AZD1775对于H3K36me3缺失的细胞更加敏感,CHK1和ATR的抑制剂也能够特异性地杀死H3K36me3缺失的细胞。目前有多种WEE1,CHK1和ATR的抑制剂正处于临床试验,因此H3K36me3缺失可以作为用药有效的一个biomarker。
其他的表观遗传相关协同致死组合
CBP和p300是两个非常类似的蛋白,分别催化H3K18和H3K27的乙酰化。在10-30%的肺癌,淋巴瘤和膀胱癌中存在CBP基因功能缺失突变;在淋巴瘤,宫颈癌和子宫内膜癌中也存在着p300失活突变。CBP和p300同时缺失会导致细胞死亡,且p300抑制剂C646能够选择性的杀死CBP缺陷的肺癌细胞。
由于临近着抑癌基因P16,MTAP在15%的癌症中都存在缺陷,因此MTAP也是个非常有潜力的广谱抗癌靶点。研究发现精氨酸甲基转移酶PRMT5与MTAP存在协同致死效应,因此PRMT5抑制剂可以被开发用于治疗MTAP缺陷的癌症。
表观遗传治疗的方向
由于相关表观遗传药物稳定性以及剂量限制的原因,这些药物在实体瘤上的效果一直不佳,因此联合用药成为了表观遗传治疗的一个方向。由于表观遗传在肿瘤免疫逃避中起到重要作用,表观遗传因子抑制剂能够促进宿主抗肿瘤免疫反应,因此免疫检查点抑制剂与表观遗传因子抑制剂的联合用药可能会表现出更好的疗效。目前,多个PD-1/PD-L1,CTLA-4单抗与DNMTs, HDACs和EZH2抑制剂联合用药正处于临床试验之中。
从FDA批准Merck的Keytruda用于治疗携带微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)分子特征的癌症患者,到ASCO2017上大放异彩的LOXO-101,用于治疗携带TRK融合基因的癌症,广谱抗癌药红极一时。而由于表观遗传突变在癌症中的普遍性,如ARID1A缺失突变在部分肿瘤中达到15-20%,因此针对这些靶点的广谱抗癌药极具前景。随着CRIPSR等技术的发展,期待能早日筛选到合适的靶点与药物。
表观遗传治疗所面对的挑战
目前,将表观遗传的实验室发现转化为临床治疗还存在很多挑战。首先是表观遗传的复杂性,单个基因的突变可能引起整个基因组范围内表观修饰的变化,从而影响转录,复制,DNA修复等多个不同的细胞过程。其次,表观遗传突变的影响是lineage-dependent的,癌症的不同亚型可能是不同的表观遗传突变造成的;在不同组织中,同一基因的改变可能会造成不同的影响;这些因素都增加了表观遗传用于治疗的复杂性。第三,由于每类表观遗传因子家族蛋白结构相似,因此抑制剂的特异性也是个非常大的挑战。也正是因为这些挑战导致大药厂积极不足,领域进展缓慢。希望能够早日出现破冰者,推动整个表观遗传药物的开发。


{replyUser1} 回复 {replyUser2}:{content}