杨力研究组合作开发新型碱基编辑器系统
近日,中国科学院-马普计算生物学研究所杨力研究组与上海科技大学生命学院陈佳研究组和黄行许研究组通过合作研究,开发出一系列基于 CRISPR/Cpf1(Cas12a)的新型碱基编辑器(dCpf1-BE),相关成果以“Base editing with a Cpf1– cytidine deaminase fusion”为题,在线发表在国际知名学术期刊《自然 - 生物技术》(Nature Biotechnology)上。
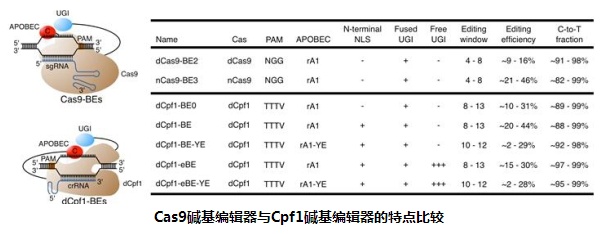
传统的 CRISPR/Cas9 基因编辑技术虽然具有较高的基因敲除效率,但在执行特定的碱基替换(譬如对造成遗传性疾病的点突变进行矫正)时效率通常很低,这极大地限制了 CRISPR/Cas9 基因编辑的应用。近期,利用 CRISPR/Cas9 和 APOBEC(胞嘧啶脱氨酶)整合而发展出的新型碱基编辑系统(Base Editor, BE),可在单碱基水平(如胞嘧啶向胸腺嘧啶)实现高效率的基因组靶向编辑改造。这种新型碱基编辑系统理论上可对数百种引起人类疾病的基因组点突变进行定点矫正,因此拥有巨大的临床应用潜力。目前已报道的碱基编辑系统均是利用 Cas9 蛋白(主要是 Streptococcus pyogenes Cas9, SpCas9 和 Staphylococcus aureus Cas9, SaCas9)执行与基因组的靶向性结合,而这种靶向性结合依赖于靶点旁侧的 PAM(Protospacer Adjacent Motif)序列。SpCas9 和 SaCas9 蛋白所识别的 PAM 序列多含鸟嘌呤 / 胞嘧啶(G/C-rich),因此利用已报导的碱基编辑系统无法在腺嘌呤 / 胸腺嘧啶富集(A/T-rich)区域进行高效的碱基编辑操作。
在这项最新的研究中,科研人员构建了一系列基于 CRISPR/Cpf1 蛋白的新型碱基编辑器(dCpf1-BE)。由于 Cpf1 蛋白可识别富含腺嘌呤 / 胸腺嘧啶的 PAM 序列,这种基于 Cpf1 的新型碱基编辑器实现了在腺嘌呤 / 胸腺嘧啶富集区域的碱基编辑操作。在拓展了可编辑区域的同时,基于 Cpf1 的新型碱基编辑器所产生的编辑副产物也较低,因此具有更高的编辑精准度。这种基于 Cpf1 的新型碱基编辑器与现有的基于 Cas9 的碱基编辑器可实现碱基编辑的有效互补,为碱基编辑系统在基础研究及未来临床领域的全面深入应用提供了新方法、拓展了新思路。
杨力研究员长期从事计算生物学和组学研究。在此项最新的合作研究中,利用计算和实验相结合的高通量体系,成功开发出一系列基于 Cpf1 的新型碱基编辑器系统,实现了在腺嘌呤 / 胸腺嘧啶富集区域的碱基编辑操作。在与陈佳教授前期的一系列合作研究中,阐明了 APOBEC 在 CRISPR/Cas9 引起的基因组 DNA 断裂修复过程中产生突变的分子机制(Lei et al., 2018, Nature Structural & Molecular Biology)并成功合作开发出了增强型的基因组碱基编辑系统(Wang et al., 2017, Cell Research)。
该工作在杨力研究员、陈佳教授、黄行许教授的共同指导下,由陈佳研究组 2014 级硕博连读研究生李潇飒、杨力研究组 2015 级硕博连读研究生王滢和黄行许研究组 2014 级硕博连读研究生刘亚京等共同完成。该项研究得到了国家自然科学基金委、科技部、上海市科委和上科大科研启动基金的支持。该研究使用的高通量测序数据由 PICB Omics Core 完成,并储存于 NCBI (GEO:GSE110136)和 PICB 大数据中心(National Omics Data Encyclopedia:NODEP00371765)。
文章链接:https://www.nature.com/articles/nbt.4102
文章来源:生物360


{replyUser1} 回复 {replyUser2}:{content}