人造精子孕育
在刚刚过去的世界出生缺陷日(3月3日),世卫组织官网披露全球每年超过800万婴儿患有严重出生缺陷。剔除围产期环境因素和孕妇妊娠期用药不当等原因,绝大多数先天性缺陷都源于显性/隐性基因异常。因此明确亲代致病基因位点与遗传疾病的关联,对于孕前早期筛查的一级出生缺陷防控体系而言至关重要。
神经管异常是我国常见的重大出生缺陷之一,其中遗传因素贡献度高达70%。复旦大学王红艳课题组与中科院生化细胞所李劲松课题组合作,利用“人造精子”技术培育全雌性半克隆小鼠,仅耗时半年就成功验证神经管畸形的强致病基因位点。那么与传统二倍体基因组发育而成的模式动物相比,单倍体胚胎干细胞发育而成的小鼠有哪些特殊的研究优势?又将为重大遗传病研究和细胞重编程发展产生怎样的强大助推力?让我们到李劲松博士团队培育的特殊“女儿国”中一探究竟!

半克隆小鼠,快速锁定遗传缺陷基因
Q:人造精子技术在神经管缺陷的致病基因筛查中,如何实现其快速优势?
李劲松博士:神经管是胚胎的中枢神经系统,神经管异常之后会使胚胎产生无脑、脑部膨胀、脊柱裂、唇腭裂等症状。王红艳课题组在神经管畸形和正常对照样本中,筛选了数个潜在致病突变位点。我们团队将突变位点逐一敲入人造精子,分别培养出含有这些候选突变位点的小鼠细胞系,最后我们锁定了一系列基因位点的杂合突变会导致胚胎死亡。
传统二倍体胚胎干细胞基因打靶的周期较长,需要把胚胎干细胞注入到囊胚,发育得到种系嵌合的小鼠,再通过杂交一到两代来获得纯合动物。而以单倍体胚胎干细胞为对象进行基因研究和筛选,则会大大缩短实验周期。我们只需要将携带修饰基因的孤雄单倍体胚胎干细胞注入卵子,便能直接获得携带特定基因遗传修饰的半克隆小鼠,从而加速出生缺陷、多基因介导复杂疾病的病因分析。这正是我们得以实现快速基因筛选的关键所在。
Q:您的团队还将人造精子技术与基因剪辑技术进行了完美结合,请您谈谈相关应用。
李劲松博士:人造精子技术与最新基因剪辑技术CRISPR-Cas9结合后,可一步获得多基因同时敲入/敲除的小鼠模型,还可以培养获得携带多种基因突变的杂合小鼠模型,也能够通过小鼠个体遗传筛选从大量候选基因中快速确认重要基因。
另外我们还使用CRISPR-Cas9技术进行了有成效的受精卵基因编辑。我们将携带向导RNA的CRISPR-Cas9注入杂合子受精卵,发现1/3的新生小鼠白内障症状被治愈,且被修复的基因还可以遗传到下一代。同时我们也通过DNA测序发现,治愈小鼠中有2只存在非靶向基因位点的异常切割。
鉴于1/3的治愈率在疾病临床统计上仍然较低,以及以上实验的脱靶风险,我们又发展了精原干细胞介导的基因编辑研究。至今人类还无法在实验室条件下,直接复制天然精子和卵细胞。但利用精原干细胞,则能在体外长期稳定传代并可减数分裂出具有配子功能的精子。父系先天性白内障的病因之一,是编码晶状体蛋白的基因异常;通过体外编辑精原干细胞基因,我们发现由此培养的精子和由此发育而成的所有小鼠视觉系统都显示正常。所以精原干细胞疗法对于父系遗传疾病的治疗,是一个方向。


人造精子染色体:安能辨我是雄雌?
Q:人造精子可进行繁殖并传递基因修饰的成果列入2012年度中国科学十大进展。从孤雄单倍体胚胎干细胞到一只健康小鼠出生,有哪些关键的技术里程碑?
李劲松博士:自然界生物的繁殖方式多样,某些低等生物可由单倍体配子发育而成;有的昆虫和低等脊椎动物存在偶发或周期性孤雌无性繁殖;甚至还存在交配后卵母细胞核直接裂解的孤雄生殖。但高等哺乳动物繁衍后代必须由精子、卵细胞的细胞核融合,才能生成完整的受精卵。至今人类尚无法直接在体外复制天然精子和卵子,但上世纪80年代已有科学家构建了哺乳动物胚胎干细胞系和囊胚。在2011年,又有科学家利用流式细胞分选仪,成功解决了单倍体细胞自发二倍体化的困扰,通过反复分选和扩增稳定建立了孤雌单倍体细胞系。
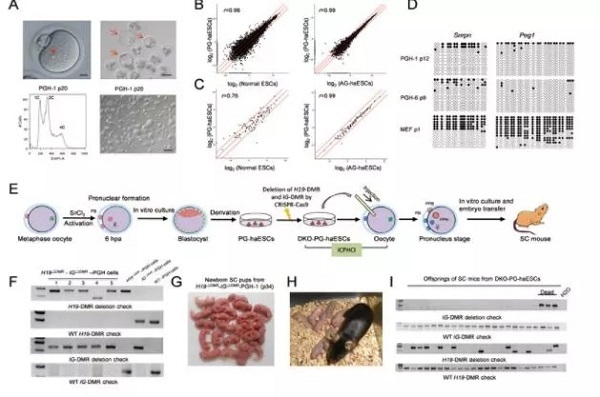
我们团队的成果是在成功培养出孤雄单倍体细胞系之后,将人造精子注入卵子培养为“受精卵”。 人造精子随着体外培养传代,会逐渐失去产生半克隆小鼠的能力,其中一个原因就是印记基因的擦除和变化。我们在孤雄单倍体胚胎干细胞中敲除了H19-DMR和IG-DMR基因,即通过修改调整“人造精子”的相关印记基因表达,最终将半克隆小鼠发育成功率大大提升至20%。目前利用孤雄单倍体细胞培养的动物全部为雌性,原因是携带Y染色体的精子不能形成孤雄单倍体胚胎干细胞,这说明X染色体含有细胞发育不可或缺的重要基因。

Q:在孤雄单倍体胚胎干细胞研究成果发布之后,您的团队为何还要研发孤雌单倍体细胞?请您谈谈具体研究。
李劲松博士:建立精子来源的孤雄单倍体胚胎干细胞系需借助复杂的核移植技术,这仍然限制了单倍体细胞技术的应用。为此,我们也希望同步尝试用卵子代替精子建立单倍体细胞系。其实从上世纪80年代到2011年的重要单倍体胚胎干细胞研究,建立的都是孤雌单倍体细胞系,但即便实现稳定的细胞系扩增,仍然无法培育出胚胎。我们团队也曾通过化学物质在体外孤雌激活卵子,由此产生的孤雌单倍体胚胎干细胞直接注入卵子后可产生胚胎,但移植到小鼠子宫内,同样无法发育为个体。
所以我们转变思路,希望将天然卵细胞改造为精子使用。通过对全基因组以及所有印记基因的表达进行高通量测序,我们发现孤雌与孤雄单倍体胚胎干细胞具有非常相似的表达模式:因为孤雌单倍体胚胎干细胞的雌性印记基因,在细胞建立和传代过程中也会快速丢失,逐渐形成类似于孤雄单倍体胚胎干细胞的基因表达模式。
基于之前对孤雄单倍体胚胎干细胞的印记基因改造经验,我们也尝试对孤雌单倍体细胞进行H19-DMR和IG-DMR基因敲除,同样成功产生了类似于孤雄单倍体细胞的类精子,并且能达到15.5%的半克隆小鼠出生率,之后这些小鼠均能健康发育到成年并具有生育能力。这证明了哺乳动物孤雌发育的可能性,即胚胎中的两个基因组拷贝都来自于卵子。目前还有其他学者采取不同方式,将卵子甚至雌性动物体细胞改造为人造精子,让模式动物构成的“女儿国”在实验室内存在永续利用的可能。
“女儿国”细胞系的远大前程
Q:在人类和动物遗传病、不孕不育治疗领域,基因剪辑和细胞重编程技术有哪些应用前景和挑战?
李劲松博士:这些技术应用于人类胚胎基因编辑和克隆的伦理风险很明确,我个人也持否定意见。但是克隆技术在动物繁殖领域已有很多成熟应用,韩国等国家已广泛开展家畜和宠物克隆。但是大体型濒危动物的克隆还存在一些挑战。学生时代,我参与的课题组曾试图将大熊猫细胞系和黑熊卵子结合,来克隆我们的国宝大熊猫。我们曾成功培养出克隆胚胎,但移植到黑熊子宫内便发生流产或胎停现象。但如果我们的细胞重编程技术能够有所突破,濒危动物克隆对于生态环境的保护和研究会有很大帮助。
人类胚胎基因编辑至今仍不可接受和应用。最新人工辅助生殖技术仅限于从候选胚胎中,利用桑椹胚细胞基因测序,挑选天然基因正常的胚胎并移植进入母体子宫。另外在技术层面,胚胎或精原干细胞基因剪辑仍存在脱靶效应,我们需优化方法才能100%避免基因组非靶向位点突变。
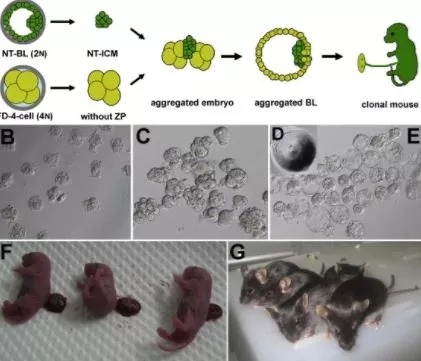
对于细胞重编程技术在生殖领域的应用,也仍然还仅限于模式动物。克隆和半克隆技术培养的胚胎存活率水平并不高,全克隆囊胚中只有3%能发育为克隆动物,而且需要广泛采用复杂的四倍体胚胎补偿技术。将四倍体胚胎与二倍体胚胎聚合成一个胚胎,在聚合胚胎的发育过程中,四倍体的细胞绝大部分发育成胚外组织,而胎儿则是由二倍体发育而来。这些结果充分证明克隆囊胚的滋养外胚层中存在重编程异常并影响胎儿发育。而通过半克隆技术培养出的小鼠胚胎,我之前已经提到成活率在20%左右,对于实验室动物研究非常可观,运用于人类辅助生殖则不能想象。
Q:对于您的团队和整个研究领域而言,您觉得未来有哪些发展方向?
李劲松博士:不论是天然精子与卵子结合,还是通过细胞重编程实现的克隆/半克隆,配子的表观遗传模式都会在受精之后大规模改写,并结合产生具有细胞全能性的受精卵。全克隆操作过程中,在去核卵细胞的作用下,体细胞核作为终末分化细胞核的分裂次数还会被清零。由此可见生殖细胞的强大分化能力和孕育生命的神奇力量。正因为如此,天然配子的体外获得仍然是一个难题,希望未来有所突破。另外单倍体胚胎干细胞在体外培养时,如果不采用流式细胞分选仪则会100%发生自发二倍体化,隐藏在有性生殖背后的调控机制仍是未解之谜,我也非常渴望有人能够在未来破解这个谜团。
我们课题组最近参加了基因组标记(genome tagging)的大型项目。人类基因组测序计划完成之后,确认了26000多个编码蛋白质,至今有42%蛋白质功能研究还是空白,抗体开发是蛋白质组学的瓶颈之一。因为针对不同的蛋白质,抗体种类繁多且亲和度不够稳定,所以我们希望让所有蛋白质都带上同样的DNA序列标签,这段序列本身也能够编码蛋白质。由此利用一种针对标签DNA序列编码蛋白的抗体,就可以结合所有26000多种人体基因组编码蛋白质。这是一个非常庞大的项目,我们希望利用“人造精子”技术,快捷建立分别携带这些蛋白质的26000多个小鼠“人造精子”细胞系和标签小鼠库,为实现蛋白质功能网络和生命科学研究的划时代突破提供强大动力!
文章来源:药渡网


{replyUser1} 回复 {replyUser2}:{content}