我国学者在内皮细胞分泌调控血管稳态机制研究方面取得重要进展
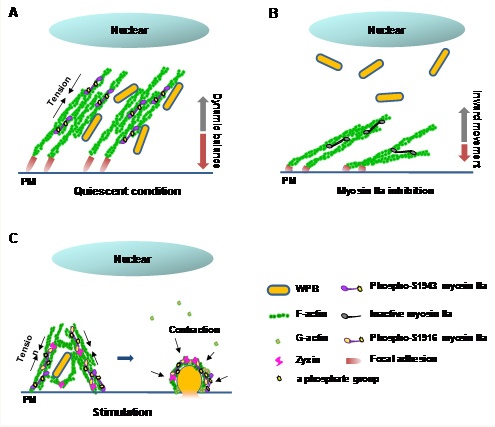
图. 肌球蛋白 Myosin IIa 调节 cAMP 诱导的内皮细胞中 WP 小体分泌的变阻器模式。
在国家自然科学基金项目(项目编号:91339111,81470298)等资助下,北京大学分子医学研究所罗金才教授团队在内皮细胞分泌调控血管稳态机制研究方面取得新的进展,相关研究成果以“Myosin IIa is Critical for cAMP-mediated Endothelial Secretion of von Willebrand Factor”(Myosin IIa 在 cAMP 介导血管内皮细胞分泌 VWF 过程中的关键作用)为题,于 2018 年 2 月 8 日在《血液》(Blood)杂志上在线发表。北京大学分子医学研究所罗金才教授为文章的通讯作者,博士研究生李品和魏国琴为共同第一作者。论文链接 http://www.bloodjournal.org /content/131/6/686.long? sso-checked=true。
血管内皮细胞作为调控止血、血栓形成和炎症等生理过程的体内屏障,其发挥作用的重要机制之一是 Weibel Palade 小体(WP 小体)的分泌。WP 小体是血管内皮细胞中的重要囊泡,其中包含多种凝血和炎症相关因子,如 von Willebrand 因子(VWF)等。该团队前期在 Nature Communications 上报道了细胞粘附斑分子 Zyxin 是一种全新的内皮分泌调控分子。后续在该研究中,通过蛋白结合组学发现 Myosin IIa 是其结合蛋白含量最多的蛋白。运用原代培养内皮细胞发现,下调 Myosin IIa 基因表达可以显著抑制 cAMP 激动剂引起的 VWF 分泌。而在体实验中发现,内皮 Myosin IIa 敲除小鼠呈现出血时间延长、血栓形成减慢等表型。此外,研究发现通过抑制 Myosin IIa 的活性,会干扰成熟 WP 小体在内皮细胞内的正常分布。在对 cAMP 信号的响应中,Myosin IIa 的活性对于 WP 小体周围的功能肌动蛋白框架的形成至关重要。而 Myosin IIa 与 Zyxin 的相互作用也对 cAmp 诱导的 VWF 分泌非常重要。
运用最新发展的活细胞超高分辨率成像技术,该团队发现 Myosin IIa 对 WP 小体分泌起着变阻器样调控模式(图):在静息状态下,Myosin IIa 通过丝氨基酸 1943(S1943)的磷酸化保持低水平活性,维持成熟 WP 小体的外周定位;受到刺激后,进一步使丝氨基酸 1916(S1916)也发生磷酸化,促进其与 Zyxin 蛋白结合,共同调节膜下微丝分子网络与囊泡的相互作用。
同期《血液》刊登了题为“Myosin IIa Signal von Willebrand Factor Release”的述评文章,指出该研究在血管内皮细胞分泌调控机制方面所做出的原创性发现,并强调对一些遗传性出血疾病的防治具有潜在的意义。
文章来源:生物360


{replyUser1} 回复 {replyUser2}:{content}