Nature:6 位科学界意见领袖分享 2018 年最期待的前沿科技
意见领袖展望有望在 2018 年变革生命科学研究的技术和主题。
重新编码基因组
George Church:哈佛医学院遗传学家
虽然基因编辑工具 CRISPR 非常火热,但是它并没有那么高效或精准,而且很难一次做出大量修饰。我的实验室目前创下的记录是对一个单细胞的基因组做出 62 个修饰,但是我们迫切期望的应用实际要求远不止于此。尽管如此,现在我们已经拥有了可以让这一点变成现实的技术。
“密码子重编码”是一种完全通用的可以让任何有机体抵抗大部分或所有病毒的方式,需要对单个细胞做成千上万的精准修饰。一个密码子(比如 TTG)对应一种特定的氨基酸(如亮氨酸)或一个转译信号(开始、停止等)。由于亮氨酸有 6 个密码子,我们可以利用遗传密码冗余,将其中任意一个换成另一个。转换完成后,我们将与被换掉的密码子相匹配的亮氨酸 tRNA 的基因删除,这样细胞就无法再识别该序列。
现在,当病毒感染一个包含所有这些被重编码的密码子的细胞时,由于缺少 tRNA,它无法从其信使 RNA 翻译蛋白质,最终就会死亡。病毒并没有那么顽强;要破坏它们不用太费事。
为了可以一次做出多重精准修饰,我们采用了多元自动化基因组工程(MAGE)技术,将包含想要的精准碱基对修饰的遗传物质短片段引入不会做出 DNA 错配修复的细胞。经过几轮的细胞复制后,这些修饰就会完全融入细菌基因组。
理论上而言,这适用于每一个面临病毒威胁的有机体——乳制品工业使用的微生物以及在农业上具有重要意义的动植物。此外,研究人员还可以制造抗病毒猪,用于器官移植;也可以制造抗病毒人体细胞,用于制药和疫苗。
这里真正厉害的地方是,你有望制造出能抵抗所有病毒的有机体,甚至是从未研究过的病毒。当然,重编码的用途远不限于此。哈佛医学院的 Pamela Silver 和合成基因公司(Synthetic Genomics)的 Daniel Gibson 一起合作,开发出了另一种重编码技术,它可以改进肠道沙门氏细菌(Salmonella typhimurium)的疫苗株。
研究人员也可以重编码有机体,使之包含非标准氨基酸,产生在目前有机体中不存在的化学反应:会发荧光、类似核酸或形成不寻常键的氨基酸。当你不局限于全部常见的 20 种氨基酸时,就会看到生物化学崭新的维度浮现出来。英国剑桥 MRC 分子生物学实验室的 Jason Chin 研究组正在使用这种方法,在分子水平上对果蝇的蛋白质做精准改动。
最后,重编码提供了一种有力的生物防护策略。如果一种抗病毒有机体逃逸,即使它们对环境不“坏”,它们也会获得自然生态位而“取得胜利”。你可以利用某一种非标准氨基酸,改造有机体,使之只在具备特定营养素的情况下才能生长。这样就可防止实验室内实验性有机体“逃逸”。
转录组图谱绘制
庄小威:哈佛大学高级成像中心主任
最新启动的人类细胞图谱计划(HCA)有一个宏大的目标——鉴定人体内的所有细胞类型并绘制出它们的空间组织。规模如此之大的一个项目需要大量互补的技术。
单细胞 RNA 测序是鉴定不同细胞类型的一种有力方法,也是实现 HCA 的一个重要工具,但是它要求将组织分离成单个细胞,再分离 RNA。因此,无法保留细胞在组织中的空间背景——它们是如何组织起来相互作用的。
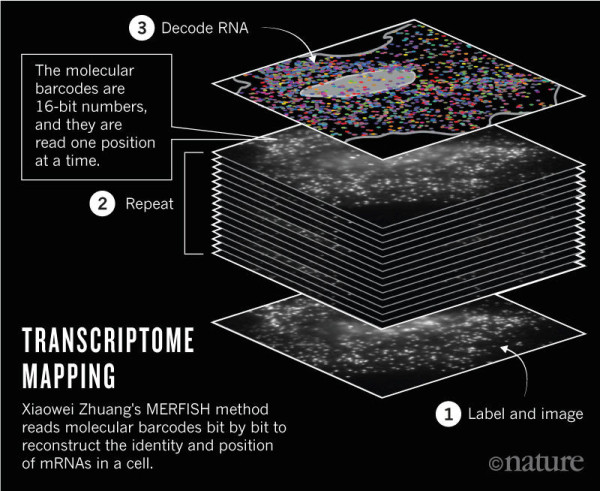
我们希望有一种技术可以提供这种空间背景:成像完整组织内的细胞的转录谱。我的实验室正在开发多重抗误差荧光原位杂交技术(MERFISH),即一种基于图像的单细胞转录组学方法。
MERFISH 利用抗误差条码鉴定细胞内不同类型的 RNA,利用组合标记和序列成像多重检测这些条码。
我们已经证明能够成像单细胞内的 1000 个不同的信使 RNA。经过进一步的发展,MERFISH 有望可以检测完整组织内的细胞的所有转录组。
这种空间分辨 RNA 概况数据将为我们提供 HCA 的物理图像——我们可以成像单个细胞,根据它们的基因表达谱给它们分类,进而绘制出它们的空间组织。与利用其它成像技术获取的细胞形态和功能数据相结合后,就能让细胞图谱变得更加完整。
目前,我们的细胞图谱仍是不完整的。如果你没有完整的图谱,你就不知道你遗漏了什么,更不用提如何设计有效的疾病疗法了。
癌症疫苗
Elaine Mardis:美国俄亥俄州全国儿童医院遗传医学研究所联合执行主任
癌症免疫基因组学领域的研究人员希望知道哪些癌症基因组编码的突变蛋白质能够触发个体体内的免疫反应。这类蛋白质被称为新抗原(neo-antigen),可利用它们开发个人化癌症疫苗或其它疗法。
CyTOF 正可以用来研究这些新抗原,CyTOF 是一种质谱细胞术,可以鉴定表达特异蛋白的细胞。
在典型的流式细胞术中,研究人员将用荧光分子标记的抗体与细胞混合起来,来标记目标蛋白。之后,逐个分析这些细胞,根据那些蛋白测量它们的相对丰度。CyTOF 用金属标签取代了数量有限的荧光标记,金属标签可以通过质谱仪检测,一次可以检测 100 多个,而流式细胞术只能检测 12 个左右。
这一技术让研究人员可以弄清楚癌细胞产生的哪些新抗原是最丰富的,哪些最有可能引起强烈的免疫系统反应,从而有望给癌症免疫基因组学领域带来变革。 研究人员可以据此制造个人化的抗癌“疫苗”。疫苗与新型癌症药物(通过激活免疫系统作用)相结合,有望帮助癌症患者战胜病魔。
不过,对于基因组预测的任何给定新抗原,它是否会引起强烈的免疫应答仍得要靠猜。CyTOF 为我们解答这个问题提供了线索,它让我们可以量化预测出来的多种肽与个体 T 细胞结合的强度。
CyTOF 不仅仅可用于癌症基因组学领域,还可用于追踪细胞产生的任何蛋白质组合的丰度和组成——只要你能找到可以与目标蛋白质结合的抗体。因此,我们能够以前所未有的更多维、更精准的方式,在蛋白质水平上提出问题。
将基因型与表型关联起来
Ruedi Aebersold:苏黎世联邦理工学院分子系统生物学研究所系统生物学家
显然,我们生活在一个非常精彩的时代——有关遗传变异性的高质量基因组信息数不胜数。不仅如此,我们可以收集大量与人体健康有关的信息,包括每日行走步数、血压和临床成像结果。问题的关键是如何将这两种信息关联起来。特别是在医学领域,如果我们想要将遗传变异转化为一种疗法,我们就需要清楚地理解疾病破坏过程的机制。
关联的重点就在于分析蛋白复合体——细胞的功能单元。那么,如何才能利用大数据(如卵巢癌基因组)弄清楚哪些蛋白复合体受到干扰,如何被干扰的?
一种做法是将计算与定量蛋白质组学结合起来,对肿瘤和对照样本中的数千种蛋白质进行准确一致地定量分析。现在,这类数据集可以利用质谱技术(如 SWATH-MS)生成。一般认为复合蛋白的协同变异程度较高,即丰度同步增减。但是,如果蛋白复合体被破坏,因为变异或结构变化而丢失了亚基,那么亚基协同变异则会有所不同。这是确定在癌症中受到干扰的蛋白复合体的一种方式。
之后可以利用冷冻电镜单颗粒分析方法或冷冻电子断层扫描术(CET)在结构层面上研究这种变化的蛋白复合体,这两种技术都能够以 5–10 埃左右的分辨率成像分子,足以展示变异如何改变了受影响蛋白复合体的组成、拓扑和结构,进而推断功能方面的变化。
CET 还能够揭示其它变化(如新增磷酸基)会如何改变蛋白复合体结构。2018 年的一项重大进展将是聚焦离子束刻蚀技术的改进。对于厚度不适合 CET 处理的哺乳动物细胞或组织切片,可以利用聚焦离子束刻蚀技术在细胞上打开一个小窗口,从而可以在细胞背景下观察特定蛋白复合体的结构。
综合而言,这些技术将促进我们了解在疾病情况下,蛋白复合体在分子水平上如何受到干扰。这将阐明可以如何设计药物来破坏、灭活该蛋白或恢复其正常活性。
扩展基因组序列分析
Rebecca Calisi Rodríguez:加州大学戴维斯分校生殖生物学家
我刚读研究生时,被 2000 年发现的一种全新激素——促性腺激素抑制激素(GnIH)深深吸引。在应激情况下,动物的 GnIH 会抑制生殖轴。关于 GnIH 的研究正在彻底改变我们对于大脑如何调节生殖的理解。我当时在想,“嘿,还有什么是我们不知道的?什么时候会有下一个彻底改变我们对生殖的理解的发现?”
如今,得益于高通量 DNA 测序技术,新发现产生的速度不断加快。15 年前,测序人类基因组需要约 30 亿美元,但现在只需要几千美元,而且价格仍在不断下降。这一点很重要,因为它使我们能够调查那些在生态系统和生境中演化、通常不在实验室研究的动物,从而有可能得到更多生理相关数据。
作为一名生殖生物学家,我特别高兴看到它可以促进我们理解性行为和生殖背后的机制——这也许是一支伟大的交响乐,也许是一段刺耳杂音。
我们最近利用 RNA 测序,更深入地了解了原鸽的生殖轴的应激反应。慢性应激可能干扰生殖,而我们想要知道所有可能造成这种后果的方式。
我们正在研究在应激情况下,生殖轴(下丘脑、脑下垂体和生殖腺)中转录活跃的每一个基因的活性。根据所得的海量数据产生了成百上千种假设,探讨应激对于潜在新生殖机制的影响。这将引导我们实现利用遗传干预或疗法治疗不孕不育的男女。
不过,我们也可以后退一步,研究现实世界中动物这一整体,这么做也是有益的。举例来说,可以将野鸽作为一种模式生物,用来评估暴露在环境中的有害物质下会对生殖轴产生什么影响。我们的发现表明,生活在相同环境下的野鸽与人类面临类似的暴露威胁。我们可以把鸽子作为环境中有害物质的生物指示物,就像金丝雀曾被用于煤矿中一样。测序技术让我们可以确定暴露在这些环境下可能对受到良好保护的生殖系统产生什么影响。
我们可以将我们了不起的新技术与“老派”科学工具结合起来,以前所未有的方式推动发现的进程。我们可以实时观察环境中的鸽子,描述其基因组和蛋白质组的变化,考察生殖所受的影响。我们是这个时代里基因层面上的自然历史学家。
打造科学物联网
Vivienne Ming:加利福尼亚 Socos Labs 公司理论神经科学家兼执行董事
现在,物联网在人们的日常生活中变得越来越普遍,Alexa、Google Home、Nest 恒温器和智能手机都是物联网的构成部分,它们是大型智能的传感器和执行器。Alexa 是由亚马逊开发的互联网智能助手,我们一般把它当成一个独立的个人助手,但是更准确的看法是把它视为一个大型分布式多重传感器阵列中的一员,这样的阵列已经覆盖成千上百万的家庭,源源不断地为实验系统提供数据输入,这才是真正的 Alexa。它不是上百万个个体机器人,而是一个在不断认识世界的单一人工智能,一个家庭的行为可能影响另一个家庭对它的探索与利用。
这些分布式智能不仅正在改变我们的日常生活,也有望变革科学研究。我希望研究人员可以开始就分布式科学物联网展开合作——将分散的传感器和执行器连接至一个强大的机器学习平台以推动开展全球性实验。我认为我们已经准备好了。即使只是一个简易的系统也能迸发无穷的力量。谷歌发现其智能手机可以通过手机加速计和陀螺仪检测到的步态变化,发现帕金森病的早期症状。我的团队利用一套扩展后的智能手机传感器,能够预测躁郁症患者的燥症发作。但是现在,大部分科学家还无法用到这样的实验力量。
想象一下,如果研究人员能够获取运行 IoST 应用的智能手机、智能手表和其它装置的数据,再辅以全球范围内更加常规的实验传感器,那将是一幅怎样的景象?除此之外,AI 系统可以挖掘与你所在领域相关的已发表研究成果和数据。类似于目前商用 AI 为销售人员鉴别隐藏的商业联系一样,IoST 的 AI 将助力科学家搜索与其领域相关的数据。如果我的神经影像软件直接接入 IoST 平台并使数据实时可访问——不仅对我的实验室,而是对所有人,那会怎么样?也许,你可以登录平台,从中了解到你应结识的 5 位新研究人员的活动。想象一下吧。
不可否认,这些大型分布式系统也有值得我们警惕的地方。某些组织会对数据拥有限制性控制权吗?通过这些新平台获取的发现将通过传统的科学出版商发表吗?或是通过阿里巴巴和亚马逊等公司?还是通过 GitHub 和 arXiv 等开放获取平台?必须立马处理有关获取和研究伦理的重大问题,因为转型正在逼近。
一些实验室和研究人员已经在利用这些可能。但是,科学共同体需要发挥带头作用。如果身为科学家的我们亲自打造这些系统,我们就能让出版变得更加平等,让数据收集变得更易分享,让科研变得更加透明。否则,别人就会掌握主动权。尽管如此,过去的传统不能忘:科学不应仅掌握在少数人手里。
文章来源:序说DNASpeaking



{replyUser1} 回复 {replyUser2}:{content}