《细胞》子刊:低蛋白饮食可激活关键信号通路 帮助杀死癌细胞
没有蛋白质就没有生命。
蛋白质是我们生命活动最重要的物质基础,好东西人人都想拥有,“坏人”也会盯上它,比如,肿瘤。
更确切地说,是想要“里面”的氨基酸。氨基酸支撑着癌细胞生长增殖过程中的代谢途径,肿瘤生长过程中新血管壁的形成也需要大量由甘氨酸、缬氨酸等合成的弹性蛋白,尤其是甘氨酸,几乎占到弹性蛋白组成的 1 /4。
甘氨酸是一种非必需氨基酸,它对肿瘤生长的促进作用已经被不止一次地证实了,和它携手被钉在柱子上的还有另一个非必需氨基酸——丝氨酸。在去年的《自然》杂志上,英国比特森癌症研究所的研究人员在肠癌和淋巴瘤小鼠模型中就发现,不含丝氨酸和甘氨酸的饮食将生存率提高了一半 [1]!
不过要想完全在饮食中剔除某种或某几种氨基酸,还是比较麻烦的,大概需要特制饮食了,那么如果整体减少蛋白质的摄入这种简便的操作会可行吗?
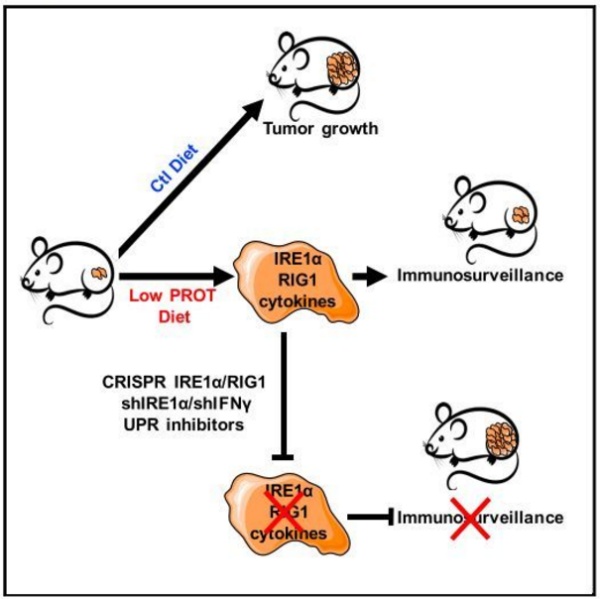
在最近的《细胞代谢》杂志中,来自法国的 Jean-Ehrland Ricci 博士带领团队给出了答案,可行!而且他们还发现了这其中的分子机制。低蛋白饮食可以激活一条关键的 IRE1α/RIG1 信号通路,诱导内质网中的未折叠蛋白反应,杀死癌细胞 [2]。听不懂在说啥?没关系,往下看,奇点糕在下面给大家仔细解释。
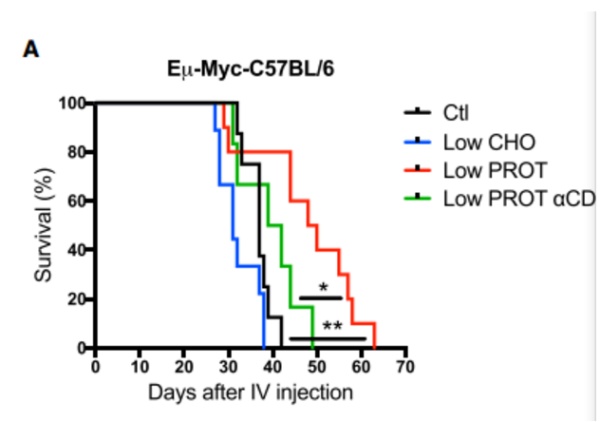
在淋巴瘤、结直肠癌和黑色素瘤这三种肿瘤小鼠模型中,降低了 25% 蛋白质含量,但不降低总能量的饮食使得它们的肿瘤生长被抑制,也提高了生存率。在淋巴瘤小鼠中,移植肿瘤 40 天时,普通饮食的小鼠全部死亡,而低蛋白饮食的还有 80% 存活!
不过,这么好的效果倒不是因为“缺衣少食”的窘境杀死了癌细胞,而是通过增加 T 细胞的水平,增强免疫反应实现的。T 细胞的激活需要抗原提呈细胞将癌细胞暴露的表面抗原“交给”未激活的 T 细胞,所以,抗癌免疫反应的增强还有抗原提呈细胞的一份力量。
淋巴瘤小鼠存活率随时间的变化,黑色为对照,蓝色为低碳水化合物,红色为低蛋白,绿色为低蛋白 + T 细胞耗尽
是谁刺激了免疫反应的增强呢?是癌细胞内部,免疫系统的“内应”——γ干扰素,这是一种关键的免疫调节细胞因子,能够广泛的激活免疫系统,还有细胞毒性,杀死肿瘤血管的上皮细胞,破坏血管 [3]。在小鼠有肿瘤的淋巴结中,γ干扰素的表达明显增多。
γ干扰素又是怎么增加的?让奇点糕带大家继续抽丝剥茧,这就涉及到更深层次的分子机制的探索了。以前有研究表明,氨基酸的减少,会导致大量未折叠和折叠错误的蛋白在内质网中堆积,出现内质网应激[4]。
内质网是非常重要的细胞器,维持细胞稳态,也是蛋白质完成折叠,形成最终三维立体结构的场所。内质网应激状态会干扰正常的细胞功能,为了“自救”,内质网会启动未折叠蛋白反应,暂停新蛋白质的生成,同时降解错误折叠的蛋白,促进未折叠的蛋白折叠。如果这样还不能平复内质网应激的话,就会启动凋亡程序,让细胞“自杀”。
未折叠蛋白反应的启动有三种信号途径,这次的低蛋白饮食激活了其中的一种——肌醇需求激酶 1α(IRE1α),增加内质网应激相关的蛋白的表达。研究人员还顺藤摸瓜找到了它的下游分子 RIG1。
这和γ干扰素的产生有什么关系?实际上,IRE1α与激活免疫反应的蛋白质分子 Toll 样受体协同作用正是肿瘤细胞中γ干扰素产生的关键因素 [5]。
机制的研究是没有办法在人体内进行的,那人类和小鼠究竟有没有共同之处呢?研究人员利用 TCGA 癌症数据库,调查了患者样本中 IRE1a 活性与免疫细胞数量的关系。
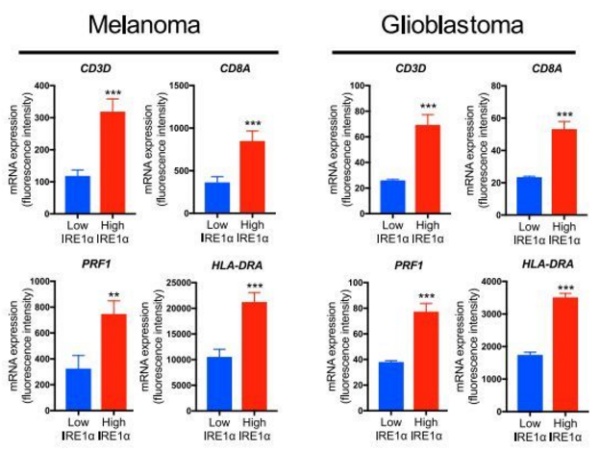
他们从 TGCA 癌症数据库中提取了 523 个胶质母细胞瘤、293 个黑色素瘤和 456 个结直肠癌患者的肿瘤样本,发现,在胶质母细胞瘤和黑色素瘤中确实是 IRE1α的活性越高,T 细胞水平越高。但在结直肠癌中,只有在肿瘤恶性程度低(I 级)时才符合这个现象。总的来说,研究人员认为,在人类癌症中,他们发现的通路也是适用的。
黑色素瘤和胶质母细胞瘤中,IRE1α和 T 细胞标志物表达水平
不过,研究人员也表示,他们的研究还存在着一些不足之处。首先,虽然整体的低蛋白饮食更容易操作,但是对于蛋白质含量具体要减少多少还没有明确的定义。蛋白质减少 12.5% 和 25% 会延缓肿瘤生长,但减少 40% 的话却没有任何效果。
而且蛋白质是人体必需的,含量过低对于本就营养不良的癌症患者来说并不友好 [6]。此外,小鼠的代谢率比人类高 7 倍,它们似乎比人类对恶性疾病的抵抗力更强[7],因此研究人员表示,关于饮食成分限制的效果需要在临床试验中进行证明。
参考资料:
[1] Oliver D. K. Maddocks , Karen H.Vousden, et al.Modulating the therapeutic response of tumourstodietary serine and glycine starvation[J].Nature,2017, 544, 372–376.
[2] Camila Rubio-Patin˜ o, Jean-Ehrland Ricci., et al.Low-protein dietinduces IRE1a-dependent anticancer immunosurveillance [J]. Cell Metabolism,2018,27, 828–842.
[3] Galluzzi L, Buque A, Kepp O, et al. Immunological effects of conventional chemotherapy and targeted anticancer agents[J]. Cancer cell, 2015, 28(6): 690-714.
[4] Jeon, Y.J., Khelifa, S., Ratnikov ,et al. Regulation of glutamine Carrier proteins by RNF5 determines breastcancer response to ER stress-inducing chemotherapies [J]. Cancer Cell,2015,27, 354–369.
[5] Martinon, F., Chen, X., Lee, A.H.,and Glimcher, L.H. TLR activation ofthe tranion factor XBP1 regulates innate immune responses in macrophages [J]. Nature Immunology,2010, 11, 411–418.
[6] Di Biase, et al. Fasting-mimickingdiet reduces HO-1 to promote T cell-mediated tumor
cytotoxicity [J]. CancerCell,2016, 30, 136–146.
[7] Bozzetti, F.,et al. Toward a cancer-specific diet[J]. Clinical Nutrition,201635,1188–1195.
文章来源:生物360



{replyUser1} 回复 {replyUser2}:{content}