《科学》:哈佛免疫学大牛发明全新抗体免疫治疗药物
在癌症治疗领域,免疫疗法的出现是毫无争议的“突破性进展”。现在大多数的免疫疗法都把目光聚焦于适应性免疫应答,也就是 T 细胞上,当然,T 细胞也很争气,不管是 CAR- T 还是以 PD-1/PD-L1 为首的免疫检查点抑制剂,效果都很好。
不过癌细胞的一大特点就是狡猾,总是能想出各种方法躲避 T 细胞的识别和追杀。不过在我们的免疫系统中,也不是只有 T 细胞才能杀死癌细胞,在先天性免疫应答中发挥主要作用的自然杀伤(NK)细胞也有这个能力,而且是优先于 T 细胞起效的。
先天性免疫应答是免疫系统的第一道防线,它不需要复杂的抗原提呈过程,而且不具有特异性,所以相对于 T 细胞来说,NK 细胞的杀伤见效更快,对非正常细胞的打击面更广。那么,由 NK 细胞介导的免疫疗法,要不要了解一下?
在不久前的《科学》杂志上,隶属于哈佛大学医学院的 Dana-Farber 癌症研究所的研究人员筛选出了一种单克隆抗体,它增强了 NK 细胞对癌细胞的识别和杀伤能力 [1]。用同期刊登的评论文章《NK 细胞加入了抗癌战役中》的说法就是,这个研究将免疫疗法的范围扩展到了 T 细胞以外[2]。
研究通讯作者 Kai W. Wucherpfennig 教授,病毒与癌症免疫学系主任
先来简单看看研究人员是怎么做到的吧。在癌细胞表面有一对儿蛋白——MICA/MICB(MHCⅠ类分子相关蛋白 A /B),它们所传递的信号是“杀了我”,这基本就是个“坏人证”了,而这两个蛋白可以被 NK 细胞的表面受体 NKG2D 识别,验明正身后,NK 细胞会释放穿孔素和颗粒酶等物质溶解癌细胞或诱导癌细胞凋亡,“就地斩杀”。
MICA/MICB 是在基因组损伤,细胞应激状态下表达的,在黑色素瘤、肺癌和白血病等等多种类型的癌细胞表面都有表达,它们也是最早被发现能够与 NKG2D 受体结合的配体。
癌细胞既然能躲避 T 细胞的追杀,自然也能想办法躲避 NK 细胞,最直接的办法就是丢掉 MICA/MICB 这张“坏人证”!于是癌细胞会释放多种酶水解掉这两个蛋白,并且让它们从细胞表面脱落,这下子,和 NKG2D 受体结合的配体没了,NK 细胞就不会把癌细胞当坏人杀掉了。
所以,研究人员的思路就是,把 MICA/MICB 牢牢地栓在癌细胞表面,让癌细胞丢不掉它们,这样就可以招募 NK 细胞来干掉肿瘤了!循着这个思路,研究人员筛选出了这个名为 7C6 的单克隆抗体。
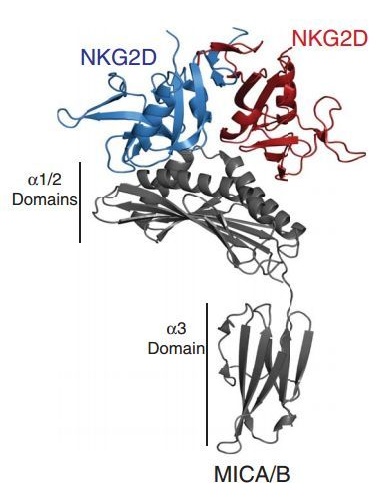
根据以往的蛋白结构的研究,MICA 和 MICB 的结构域可以分为三个部分,其中α1 和α2 负责和 NKG2D 结合,而α3 则负责粘附在癌细胞表面,所以它们被水解并脱落主要的作用靶点就在这个α3 位置 [3,4]。所以这个单抗需要高特异性绑定α3 结构域,而且还不影响α1 和α2 与 NKG2D 结合。
MICA/MICB 的蛋白结构域
他们设计了三种单克隆抗体,经过多个癌细胞系的逐一验证,发现其中的 7C6 的“绑定效果”是最好的,而且 7C6 还增强了 NK 细胞杀死癌细胞的能力。
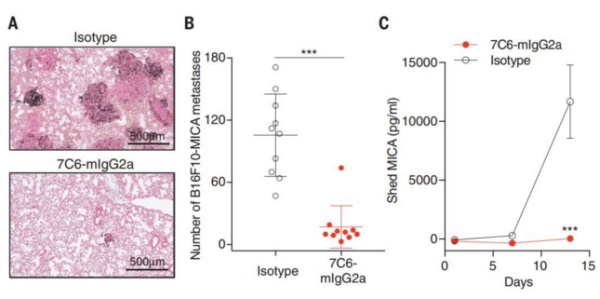
在黑色素瘤和结肠癌肺转移的小鼠模型中,7C6 单抗的使用除了控制了原发灶外,还肉眼可见地消灭了转移到肺部的肿瘤,相应的,研究人员检测到的脱落的 MICA 和 MICB 也非常少,几乎可以说是没有脱落。此外,他们还将人的黑色素瘤细胞转移到免疫缺陷小鼠中,再给它们注射人的 NK 细胞和支持 NK 细胞存活的细胞因子,白介素 2。
黑色素瘤小鼠肺转移模型在接受 7C6 单抗(7C6-mlgG2a)和对照组不相干的单抗(Isotype)治疗后肺组织切片染色(A)、肺转移灶的数量(B)和 MICA 的脱落情况(C)
这些小鼠肿瘤的转移范围就不仅仅是肺部了,还出现了肝、胰腺、肾、肾上腺和脑部等多处转移,尤其是肝脏的转移非常明显,引起了严重的肝脏损伤。随后,研究人员观察到,7C6 单抗和 NK 细胞的注射对转移灶的消灭能力都不错,不过肝脏有一点小“特别”,因为他们发现,即使不注射 NK 细胞,只使用 7C6 单抗,转移灶也能被大部分清除,NK 细胞的注射会“锦上添花”,让清除更加彻底。
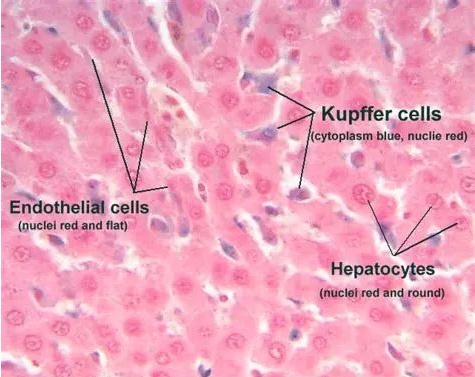
经过排查,研究人员发现,7C6 单抗的注射激活了肝脏中常驻的 Kupffer 细胞,这是一种位于肝脏中的特化巨噬细胞,像普通巨噬细胞一样具有吞噬功能。它也有能识别 MICA/MICB 的受体,所以在肝脏中,联合 NK 细胞清除转移癌细胞的效果格外好。鉴于 MICA/MICB 在很多实体瘤和血液系统癌症中都存在,所以 7C6 单抗治疗会有很广的应用范围。
肝组织切片染色,图中所示三种细胞:内皮细胞(左)、Kupffer 细胞(中)和肝细胞(右)
在评论文章中,两位评论员指出,MICA 和 MICB 基因的表达非常复杂,有很多变体,与 NKG2D 受体的结合能力也不尽相同。在这次的新研究中,7C6 单抗刚好靶向的是最常见的 MICA/MICB 变体,它们在许多肿瘤细胞上表达,但几乎不存在于健康细胞表面。
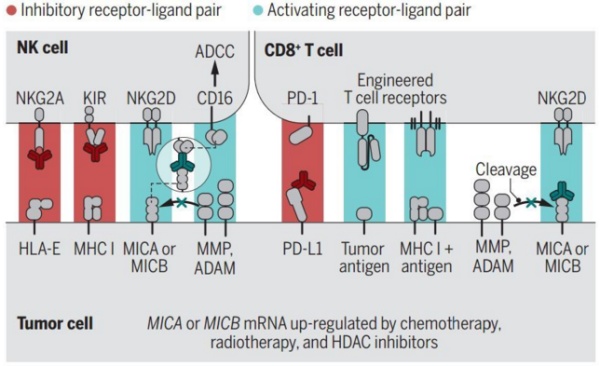
另外,除了 NK 细胞,NKG2D 受体在 CD8+ T 细胞表面也有表达 [5],也就是说,NKG2D 受体通路被激活的时候,CD8+ T 细胞也可以被激活。
NK 细胞和 CD8+ T 细胞相关的不同通路,红色为抑制通路,蓝色为激活通路,NKG2D 通路在两种细胞中都发挥激活作用
虽然在这次的新研究中,研究人员发现,7C6 单抗的使用导致的肿瘤细胞被消灭是主要由 NK 细胞介导的,但是两位评论员认为,后续还需要更多的研究来验证 CD8+ T 细胞是否也有贡献在其中,而且这也为 MICA/MICB 单抗和免疫检查点抑制剂或其他 T 细胞免疫疗法的联合治疗提供了可能。
加州大学的评论员指出,比起传统疗法直接攻击肿瘤,靶向免疫系统对抗肿瘤的新疗法是更好的选择,对于患者来说副作用会更少,预后更好,这也是它们越来越受到关注的原因所在 [6]。
参考资料:
[1] de Andrade L F, Tay R E, Pan D, et al. Antibody-mediated inhibition of MICA and MICB shedding promotes NK cell–driven tumor immunity[J]. Science, 2018, 359(6383): 1537-1542.
[2] Cerwenka A, Lanier L L. Natural killers join the fight against cancer[J]. Science, 2018, 359(6383): 1460-1461.
[3] Wang X, Lundgren A D, Singh P, et al. An six-amino acid motif in the α3 domain of MICA is the cancer therapeutic target to inhibit shedding[J]. Biochemical and biophysical research communications, 2009, 387(3): 476-481.
[4] Li P, Morris D L, Willcox B E, et al. Complex structure of the activating immunoreceptor NKG2D and its MHC class I–like ligand MICA[J]. Nature immunology, 2001, 2(5): 443.
[5] Roberts A I, Lee L, Schwarz E, et al. Cutting edge: NKG2D receptors induced by IL-15 costimulate CD28-negative effector CTL in the tissue microenvironment[J]. The Journal of Immunology, 2001, 167(10): 5527-5530.
[6] https://medicalxpress.com/news/2018-03-tumors-proteins-immune.html
文章来源:生物360



{replyUser1} 回复 {replyUser2}:{content}