《Nature》:亲核性铝负离子,会如何改变铝化学?
由于自身的缺电子性质,周期表第十三族元素(硼、铝、镓、铟、铊)普遍被当作电子受体,教科书里也以硼烷为例来介绍路易斯酸。然而近年来,亲核性的硼类化合物显示出了非常有意思的化学性质。三配位的中性硼类化合物甚至可以作为胺和膦的等电子体,以配位键的形式和过渡金属发生络合(比如Angew. Chem. Int. Ed., 2014, 53, 9280)。二配位的路易斯碱稳定的硼宾化合物也显示出惊人的双亲性性质,在常温下以“过渡金属的方式”活化惰性气体氮气。
相比于硼化学的不断进展,第十三族的其他元素的亲核性质研究却相对进展缓慢。位于第三周期的铝元素,常以+3价的氧化态存在于化合物中。我们熟知的傅-克反应(Friedel-Crafts Reaction)最常见的催化剂即为三卤化铝(AlX3)。由于铝比硼具有更强的金属性,三配位的铝元素路易斯酸性也更强。一价的铝类化合物自身热力学稳定性极低,容易发生歧化反应,仅有少数在室温下稳定的铝(I)化合物被分离表征,比如现南开大学崔春明教授在德国哥廷根大学读博士期间发现的首例双亲性单体铝(I):Al(Nacnac)Dipp(Angew. Chem. Int. Ed., 2000, 39, 4274)。近期的Nature 杂志报道了主族化学的重大突破,英国牛津大学的两位化学家Jose M. Goicoechea和Simon Aldridge成功进行了亲核性铝(I)负离子的合成、分离表征以及反应性研究。
图1. Jose M. Goicoechea博士(左)和Simon Aldridge教授。图片来源:University of Oxford
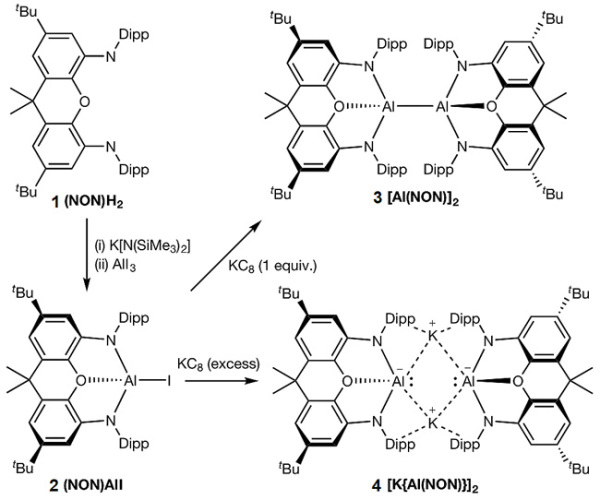
实际早在1998年,理论化学家Wolfgang Schoeller等人就预测双胺基铝(I)负离子应该会稳定存在(Eur. J. Inorg. Chem., 1998, 1998, 305)。直到20年后,Goicoechea和Aldridge研究团队才利用化合物(NON)H2(1)和强碱双(三甲基硅基)氨基钾(KHMDS,K[N(SiMe3)2])以及三碘化铝(AlI3)的反应,构建Al(III)化合物2(图2)。化合物2在不同当量的还原剂KC8的存在下,会形成Al(II)化合物3以及本文的亮点——Al(I)化合物4(图2)。
图2. 化合物2,3,4的制备。图片来源:Nature
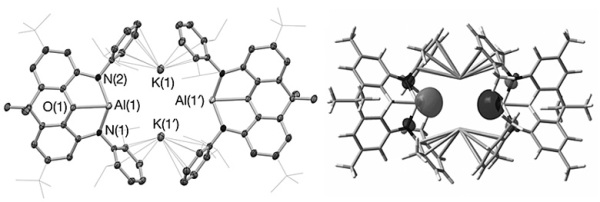
X射线单晶结构分析结果显示,除了和Al(I)直接相连的胺基外,配体中心氧原子也参与了配位稳定作用(图3)。理论计算证实该Al-O配位作用显著升高了Al(I)中心pz轨道的能量。另外,化合物4的HOMO轨道能量(−4.10 eV)比中性的Al(Nacnac)Dipp的HOMO能量(−4.70 eV)高,意味着4具有更强的亲核性。
图3. 化合物4的单晶结构(左)以及HOMO(右)。图片来源:Nature
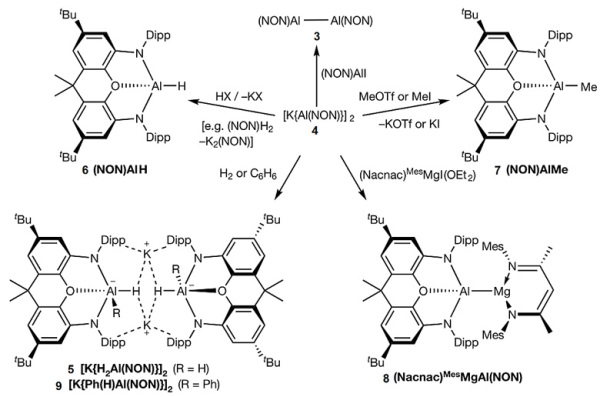
简单的亲电试剂质子或者甲基正离子可以很容易和4发生反应,形成中性化合物6和7(图4)。事实上,化合物4可以看作是第一族亲核试剂的类似物,比如我们常见的烷基锂试剂,Al(I)负离子中心类似烷基负离子。4和(Nacnac)MesMgI(OEt2)可以构建非常罕见的Al-Mg键(2.696(1) Å)。4也可以在室温下活化H2。
图4. 化合物4的反应活性。图片来源: Nature
化合物4在室温下(300 K)可以在固体状态或者苯溶液中稳定存在好几天。然而,加热至330 K,Al(I)中心可以对苯分子进行氧化加成反应。这也是首例主族元素中心对苯分子进行C-H键氧化加成反应。
至此,笔者简要介绍了Goicoechea和Aldridge研究团队的首例Al(I)负离子的合成、结构表征及反应性的研究突破。实际上,自从上世纪七十年代Seebach提出极性反转(umpolung)的概念后,极性反转已经影响了近半个世纪的研究,比如有机化学中经典的安息香缩合。利用新颖的成键模式来改变元素中心的性质,可以扩展人类对一些元素的认识,对于挖掘新型反应模式有潜在的影响。
答魔社区整理
原文:Synthesis, structure and reaction chemistry of a nucleophilic aluminyl anion
DOI: 10.1038/s41586-018-0037-y
来源:X-MOL
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。



{replyUser1} 回复 {replyUser2}:{content}