《自然通讯》三篇研究长文同期发表 介绍基因组重排技术
2018 年 5 月 22 日,天津大学元英进教授带领的合成生物学研究团队在《自然通讯》期刊同期发表三篇研究长文,文中介绍了精确控制基因组重排技术等一系列研究成果。该成果填补了基因组结构变异的技术空白,提高了细胞工厂的生产效率,加速了微生物的进化和生物学知识的发现。这是继人工合成酵母染色体打破非生命物质和生命物质界限后,中国科学家在“设计生命、再造生命、重塑生命”进程中的又一重大技术进展,开启了合成生物学研究中基因组重排这一全新研究领域。
天津大学合成生物学团队的贾斌与吴毅等人完成了《精确控制合成型单倍体和二倍体酵母基因组重排》(Precise control of SCRaMbLE in synthetic haploid and diploid yeast);天津大学合成生物学团队的吴毅与朱瑞莹等人完成了《体外 DNA 重排》(In vitro DNA SCRaMbLE);美国纽约大学 Michael Shen 与天津大学合成生物学团队的吴毅等人完成了《杂合二倍体与跨物种基因组重排》(Heterozygous diploid and interspecies SCRaMbLEing)。
在生命科学领域,遗传变异是生物进化的源泉,促使生物在亿万年间可以不断适应环境、不断进化。科学家们也开发出多种遗传变异技术,来获取多样的 DNA,从而为获取多样的生物特征提供原料。然而以前的 DNA 变异技术大多只针对基因层面进行小规模改造,在更加复杂的基因组结构变异层面的人工构建技术仍具有挑战。
天津大学科研团队正是瞄准这一难题,在去年报道的合成酵母染色体的基础上,研究出能够精准控制基因重排的方法,使作为研究对象的微生物——酵母菌,在有限时间内产生几何级增长的基因组变异,驱动其快速进化。他们还开创多种方法使变异后的酵母菌株具备稳定的生物活性,并作为细胞工厂来高效率产出β- 胡萝卜素。
酿酒酵母是生物学研究中的模式真核单细胞生物。论文《精确控制合成型单倍体和二倍体酵母基因组重排》通讯作者元英进教授表示,“化学合成酵母一方面可以帮助人类更深刻地理解一些基础生物学的问题,另一方面可以通过基因组重排系统,实现快速进化,得到在医药、能源、环境、农业、工业等领域有重要应用潜力的菌株。”
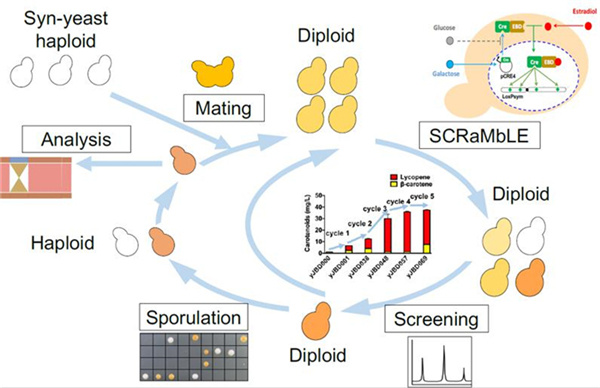
图 1:精确控制基因组重排原理示意图
“为了能够精准调控合成型酵母基因组重排过程,我们为细胞设计了一把‘与门锁’,打开这把‘锁’要用两把‘钥匙’,只有在两把‘钥匙’同时转动的状态下,细胞内的基因组重排才会开启。”贾斌告诉记者,这两把“钥匙”是指添加到菌株培养基中的两种物质——半乳糖和雌激素。“在半乳糖和雌激素的作用下,合成型酵母产生一种重组酶,使整个染色体上的重组单元随机发生缺失、倒位、重复、易位。细胞因染色体结构的重排导致细胞从基因组成、转录到表达均发生改变,产生多样的变种酵母,进而大大加速细胞的进化速度。”通过使用这一精准控制技术对合成型酵母基因组进行多轮迭代重排,酵母种类多样性得到极大丰富,研究人员从中筛选出大量高产β- 胡萝卜素的菌株,并成功验证了表达高产β- 胡萝卜素性状的基因组合。实验表明,经过 5 轮迭代基因组重排,合成型酵母菌中β- 胡萝卜素产量提升了 38.8 倍。上述成果刊发在《精确控制合成型单倍体和二倍体酵母基因组重排》一文中。
“通过建立适当的筛选目标和方法,可以快速筛选出接近目标性状的菌株;通过进一步的深度测序和长片段测序技术可以快速分析并挖掘新的基因靶点。多轮迭代基因组重排技术可以大幅加速生产菌株的快速进化,解析基因组结构变异与功能发现之间的关系,提升能源医药化学品的生产合成,对于工业菌株进化和功能知识发现具有重要意义。”吴毅说到。
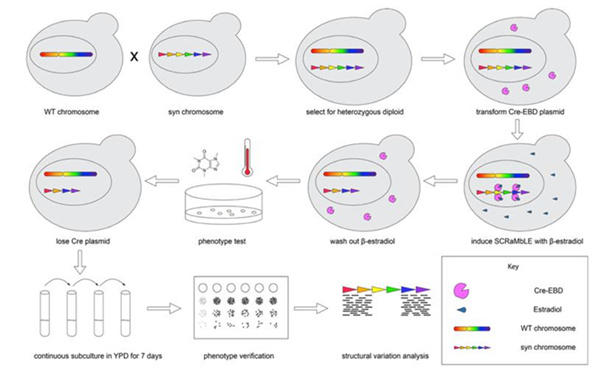
在上述研究基础上,研究人员还首次将合成型酵母基因组的重排系统拓展到杂合二倍体和跨物种二倍体菌株。相关成果刊发在《杂合二倍体与跨物种基因组重排技术》一文中。
图 2: 杂合二倍体与跨物种基因组重排技术原理示意图
据了解,作为实验对象的酿酒酵母,分为人工合成基因组的合成型酵母和未经基因组合成的野生型酵母。酵母细胞的生活周期中依据染色体数量不同分为单倍体和二倍体两种状态,可以在不同阶段发生有丝分裂和减数分裂。
研究人员通过酵母交配的方式,将合成型酵母与野生型酵母相结合,用基因组重排系统驱动杂合二倍体和跨物种二倍体的基因组重排。吴毅介绍到,“我们将合成型单倍体酵母与 25 株酿酒酵母和 27 株奇艺酵母单倍体进行交配,获得多达 100 株菌的杂合二倍体和跨物种二倍体菌株库。研究结果表明,在二倍体中开启基因组重排系统比在单倍体中有更高的存活率,基因组结构变异种类也显著提升。”
不仅如此,研究人员还分别通过杂合二倍体基因组重排和跨物种基因组重排,获得了可以在摄氏 42 度温度下生长加快的菌株和咖啡因耐受性明显增强的菌株。“杂合二倍体与跨物种基因组重排技术的开发有助于加速工业微生物的性状改良。与此同时,基因组重排对于挖掘新的生物学知识也具有重要意义。”吴毅介绍说。
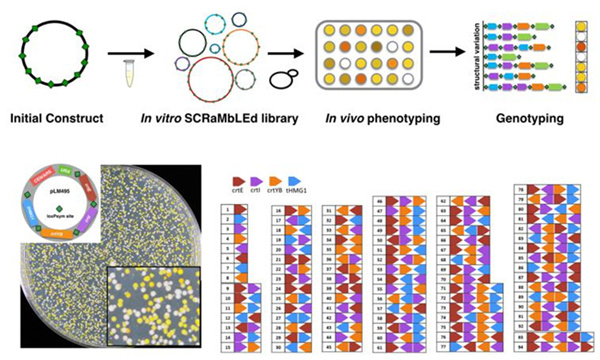
以上两种基因组重排技术还都是在酵母细胞内部实现的,但科研工作者的探索脚步仍不止于此。他们尝试脱离细胞,在体外实现 DNA 重排,开发出一种用于构建结构变异文库的体外 DNA 重排方法。成果刊发在《体外 DNA 重排》一文中。
图 3: 体外 DNA 重排技术原理示意图
“我们构建了一套 DNA 体外反应体系,产生了含有基因删除、反转和复制的结构变异文库,并且使用测序技术表征了结构变异文库的多样性。该体外 DNA 重排技术提供了一种独特且高效的构建 DNA 文库方法,有助于开展便捷的表型和结构变异基因型关联分析,对结构变异的基础研究与代谢通路的工程优化具有重要意义。”吴毅介绍到,该项成果有望在 DNA 文库构建和细胞代谢工程等领域得到广泛应用。
英国帝国理工大学的研究者们也与天津大学合成生物学团队开展深度合作,利用天津大学合成型 5 号染色体的酵母菌进行基因组重排,实现底盘细胞的快速进化,显著提升了酵母紫色杆菌素合成能力和五碳糖代谢利用能力。这一结果也同时证实了合成酵母基因组的重要性和可塑性。
据悉,合成生物学(Synthetic Biology)是继“DNA 双螺旋发现”和“人类基因组测序计划”之后,以基因组设计合成为标志的第三次生物技术革命。酵母基因组合成计划(Sc2.0 计划)是合成基因组学(Synthetic genomics)研究的标志性国际合作项目。该项目由美国科学院院士杰夫·伯克发起,有美国、中国、英国、法国、澳大利亚、新加坡等多国研究机构参与并分工协作,致力于设计和化学再造完整的酿酒酵母基因组。天津大学元英进教授是该计划的国际化推动者及中国最早参与者。此前,元英进教授牵头负责的“酵母长染色体的精准定制合成”研究成果入选 2017 年度中国科学十大进展。
上述研究均得到国家自然科学基金委、科技部 973 计划以及国际合作项目的支持。
文章链接:
https://www.nature.com/articles/s41467-018-04157-0
https://www.nature.com/articles/s41467-018-03743-6
https://www.nature.com/articles/s41467-018-03084-4

来源:序说DNASpeaking
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}