点赞!华人学者今日连发 4 篇 Nature
在今日出版的最新一期《自然》杂志上,我们很高兴地看到有 2 项来自华人学者的研究得到刊登。此外,另有 2 项来自华人的研究在线发表在了《自然》官网上。今天,我们也将为各位读者介绍这些研究。
1
刘颖教授
KLHL22 activates amino-acid-dependent mTORC1 signalling to promote tumorigenesis and ageing

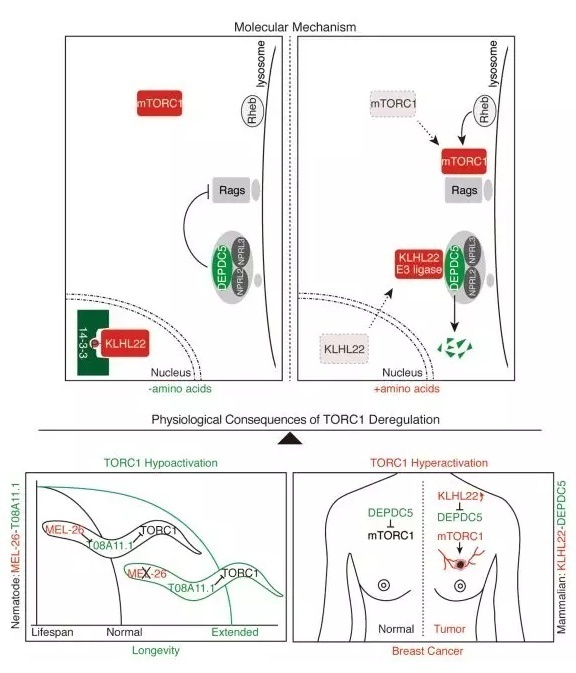
mTORC1 是细胞生长的重要调节者。如果这一关键复合体失控,就会引起代谢疾病、癌症、以及衰老等症状。我们知道,mTORC1 受到了许多环境因素的调节,其中包括氨基酸。在氨基酸的影响下,mTORC1 会被 Rag GTP 酶招募到溶酶体处激活,而 GATOR1 复合体则能行使 GAP 的活性,抑制这一过程。在这项研究中,北大 - 清华生命科学联合中心的刘颖教授团队发现在氨基酸的作用下,CUL3-KLHL22 这个 E3 泛素酶能促进 DEPDC5 的降解,而它正是 GATOR1 的关键组成部分之一。因此,KLHL22 是激活 mTORC1 通路的关键蛋白。敲除这一蛋白,不但能延长线虫的寿命,还能抑制乳腺癌细胞的生长。因此,这支团队的发现为我们带来一个潜在的重要靶点,治疗乳腺癌和年龄相关疾病。
论文地址:https://www.nature.com/articles/s41586-018-0128-9
DOI号:10.1038/s41586-018-0128-9
2
Xiuren Zhang 教授
SWI2/SNF2 ATPase CHR2 remodels pri-miRNAs via Serrate to impede miRNA production

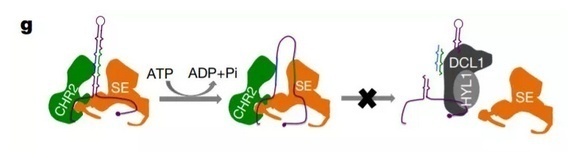
染色质重排因子(CHR)能改变染色质的结构,平时,这些因子存在于核糖核蛋白复合体中,但我们对其和 RNA 相关的功能却知之甚少。在这项研究里,来自德克萨斯州 A & M 大学(TAMU)的 Xiuren Zhang 教授课题组发现 CHR2 能促进微 RNA 前体(pri-miRNA)的转录,并抑制 miRNA 在体内的积聚。其与 Serrate(SE)的结合对于转录后 miRNA 积聚的抑制是不可或缺的。研究人员们同时发现,CHR2 能直接结合 pri-miRNA 并进行解旋,抑制它们的作用。相应的,在拟南芥中,chr2突变体与野生型的 pri-miRNA 结构有着明显不同。基于这些发现,研究人员们总结认为,CHR2 通过与 SE 的结合,改变 pri-miRNA 的次级结构,从而抑制其下游的生物学进程。这个发现也对 miRNA 的调控机制添加了新的信息。
论文地址:https://www.nature.com/articles/s41586-018-0135-x
DOI号:10.1038/s41586-018-0135-x
3
Yuxin Mao 教授
Mechanism of phosphoribosyl-ubiquitination mediated by a single Legionellaeffector

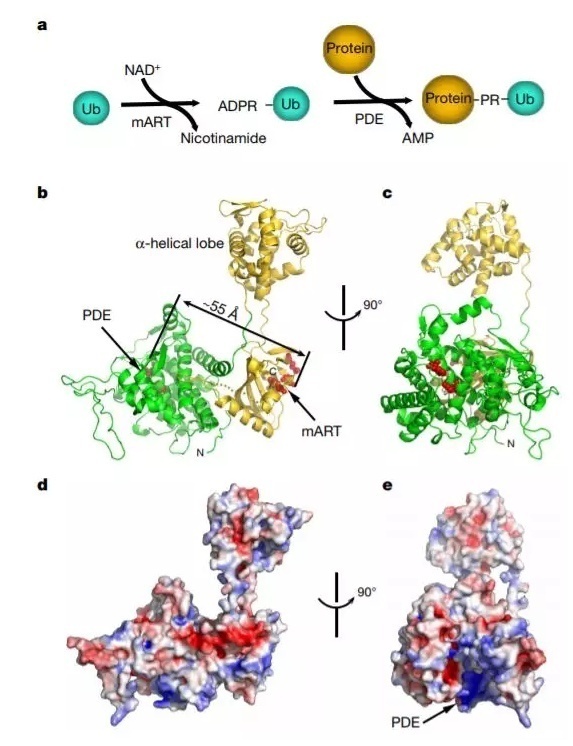
泛素化修饰是生物一大重要的转录后修饰过程,能调节大量细胞进程。在传统的模型中,泛素蛋白的 C 端与目标蛋白会发生共价连接,这往往发生在赖氨酸上。最近,在嗜肺军团菌(Legionella pneumophila)的效应蛋白 SidE 家族中,我们发现了一种全新的泛素化机制:磷酸核糖泛素(phosphoribosyl ubiquitin,PR-Ub)能与底物蛋白的丝氨酸形成磷酸二酯键。在这项研究里,康奈尔大学的 Yuxin Mao 教授团队解析了 SidE 蛋白家族成员 SdeA 的晶体结构,发现了这一独特泛素化的背后机制。原来,这一过程需要磷酸二酯酶结构域和 mono-ADP- 核糖转移酶结构域的参与,且两者的功能独立。后者能形成 ADPR-Ub,而前者能将 PR-Ub 与底物相连。此外,研究人员们也解析了 SidE 蛋白家族另一个成员 SdeD9 的晶体结构。这些发现解释了磷酸核糖泛素的分子作用机理,并有望为这一独特的泛素化过程提供更多洞见。
论文地址:https://www.nature.com/articles/s41586-018-0147-6
DOI号:10.1038/s41586-018-0147-6
4
冯越教授
Structural basis of ubiquitin modification by the Legionella effector SdeA

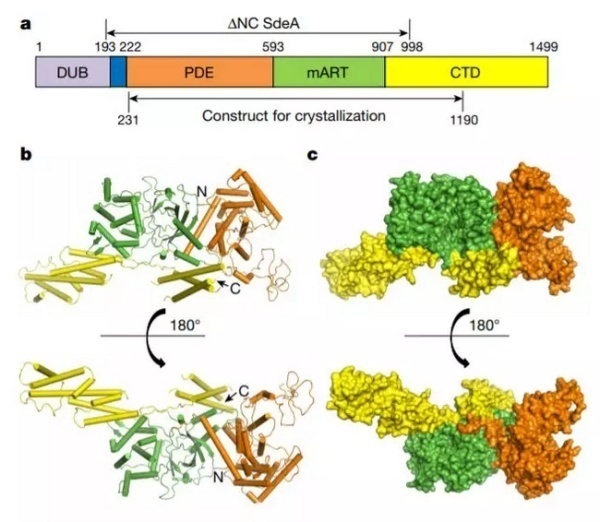
北京化工大学的冯越教授课题组也带来了一项关于创新泛素化分子机理的研究。在研究中,科学家们报道了 SdeA 在不结合配体,结合泛素,以及结合泛素 -NADH 状态下的多个结构。这些结构表明 mono-ADP- 核酸转移酶结构域和磷酸二酯酶结构域能协助 SdeA 蛋白的 C 端形成催化结构域。在泛素结合下,SdeA 会发生相应的构象变化。这项研究阐述了 SdeA 介导的泛素化修饰机制,并为后来的研究提供了重要的研究框架,让后来人能更好地理解磷酸核糖泛素的作用机理。值得一提的是,这也是北京化工大学首次在《细胞》、《自然》、以及《科学》这传统“CNS”顶尖期刊上发表论文,值得祝贺!
论文地址:https://www.nature.com/articles/s41586-018-0146-7
DOI号:10.1038/s41586-018-0146-7

来源:学术经纬
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}