《Nature》综述:抗癌药研发新平台“类器官”的具体应用
过去几年里,“类器官”(organoids)这个名词开始逐渐兴起,相信许多读者也都听说过它的名字。我们知道,类器官可以作为疾病模型协助新药研发,但它的具体应用,恐怕就不是每个人都能说清的了。近日,知名的《Nature Reviews Cancer》上发表了一篇综述,向我们介绍了类器官在癌症研发中的应用。在今天的这篇文章中,我们也将为各位读者整理其中的内容。
我们为什么需要类器官?
毫不夸张地说,在过去的几十年里,人类彻底改变了癌症的治疗格局。原本的不治之症,在今日也已经看到了有效控制,甚至是治愈的可能。
但我们也需要承认,尽管取得了诸多进展,癌症依旧是全世界的一大健康难题。预防和早期诊断之外,在癌症的防治上,我们还需要更多创新靶向疗法。然而新药研发并不是一件容易的事,将创新科学转化为有效疗法是新药上市之路的一大瓶颈。这背后的原因之一,在于我们使用的癌症模型往往不能很好地复制肿瘤的组织复杂性与遗传异质性。因此我们也可以理解,在这样的研发模式下,为何在癌症模型中取得突破的新药分子,最终会在临床试验里折戟沉沙。
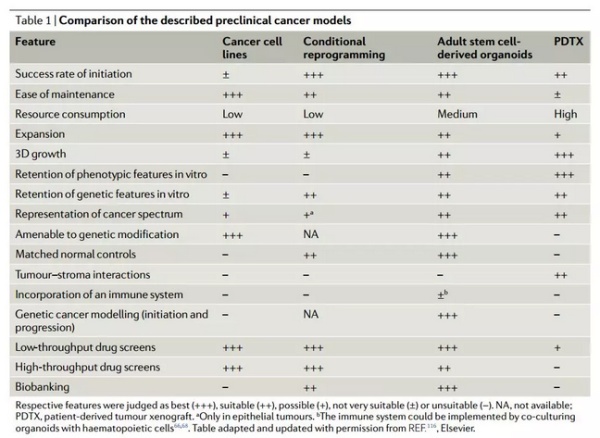
▲多种临床前癌症模型的比较,类器官有着诸多优势(图片来源:《Nature Reviews Cancer》)
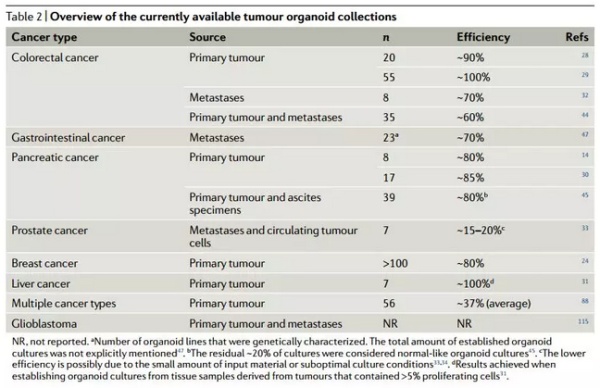
近年来,3D 组织培育技术的发展,为我们带来了全新的癌症模型。这种技术能从组织中分离出干细胞,并植入在三维的框架中,让它们分化生长成类似于器官的结构,类器官一词也就此得名。自 2009 年上皮类器官的成功建立以来,目前我们已经能有效地建立起结肠、肝脏、胰腺、前列腺、胃、输卵管、味蕾、唾液腺、食管、肺、子宫内膜、以及乳腺的类器官结构。此外,利用患者的肿瘤直接生成类器官,也是一种实际可行的手段。与诸多临床前模型相比,类器官在成功率、维护难度、筛选难度上均表现出了良好的潜力。
寻找个体化抗癌疗法
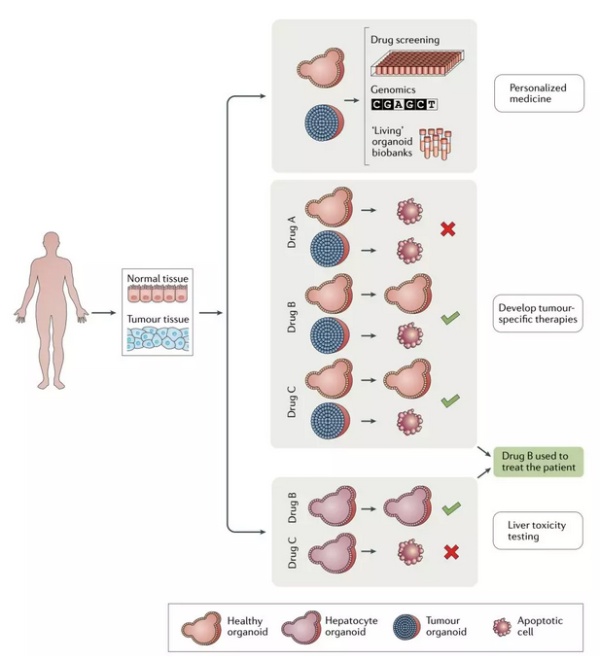
考虑到类器官能对患者肿瘤进行更好的模拟,利用这一平台,我们有望得到更多关于患者癌症的洞见,而这些洞见有望转化为个体化的抗癌疗法。目前,我们已经取得了一些可喜的结果。
在 2018 年的一篇《科学》论文上,研究人员们利用患者的肿瘤,制造出了类器官。随后,他们利用化合物库,在这些类器官中进行筛选。根据类器官实验的结果,研究人员希望能够反推出患者接受某一特定疗法的成功率。研究表明,这种预测手段的阳性率为 88%(预测疗法有效),而阴性率为 100%(预测疗法无效)!换句话说,我们可以提前知道哪些疗法对患者不起效,从而让宝贵的时间用于可能起效的疗法上,对特定的患者进行有效治疗。
▲类器官在个体化癌症疗法与抗癌新药中的作用(图片来源:《Nature Reviews Cancer》)
在另一项研究中,科学家们则利用类似的方法,来验证抗癌疗法的可行性。他们通过患者的样本,建造出了去势抵抗性前列腺癌的类器官,然后测试 CHD1 的缺失是否能增加患者对化疗的敏感度。从原理上看,CHD1 能控制 53BP1 的稳定程度。当这一基因缺失时,非同源末端连接(NHEJ)这一双链 DNA 修复过程会变得更为频繁,引入大量错误。当与损伤 DNA 的化疗药物共同出现时,就会对癌细胞进行杀伤。类器官的实验确认了这一机理的可行性,而一名患者在接受了卡铂的治疗后,病情也出现了有效的缓解。
助推肿瘤免疫疗法
在癌症治疗中,利用患者本身的免疫系统来清除癌细胞的做法已经取得了巨大成功。但在这一疗法领域,一个有待解决的问题,便是如何提高能从中受益的患者比例。研究人员们指出,由于不同肿瘤里的突变负担各有不同,肿瘤细胞展现出的免疫原性也各不相同,这造成了免疫反应的天差地别。考虑到肿瘤的新抗原未必能带来想要的免疫反应,一些科学家们正在尝试在体外对免疫细胞进行激活,再应用到患者体内。而体外激活的部分可以通过类器官来实现。
▲目前的一些肿瘤类器官模型(图片来源:《Nature Reviews Cancer》)
实际上,我们已经看到了不少初步的结果。一些研究表明,在培养基中添加 IL2、IL7、以及 IL15,能让上皮内淋巴细胞(IEL)与小鼠的肠道类器官共存数周之久,这有望帮助这些免疫细胞掌握攻击癌症的要诀;另一些实验则发现,人类原代乳腺癌上皮形成的类器官能与γδ2 T 细胞共同培养。培育后,这些 T 细胞甚至能对三阴性乳腺癌细胞进行有效的杀伤。这些结果让我们看到了类器官在肿瘤免疫疗法里的巨大应用前景。
类器官与基础研究
在《Nature Reviews Cancer》的这篇综述中,作者们也同样指出,类器官对基础研究有着重要的价值。首先,类器官可以协助阐明病原体与癌症病发之间的联系。据估计,大约有 20% 的癌症和某种病原体有关,但背后的病变机理却很少得到阐明。本综述的作者们指出,幽门螺杆菌与胃类器官的共培养、肠道沙门氏菌与胆囊类器官的共培养、以及肝炎病毒与肝脏类器官的共培养,有望帮助我们理解这些不同癌症的发病。
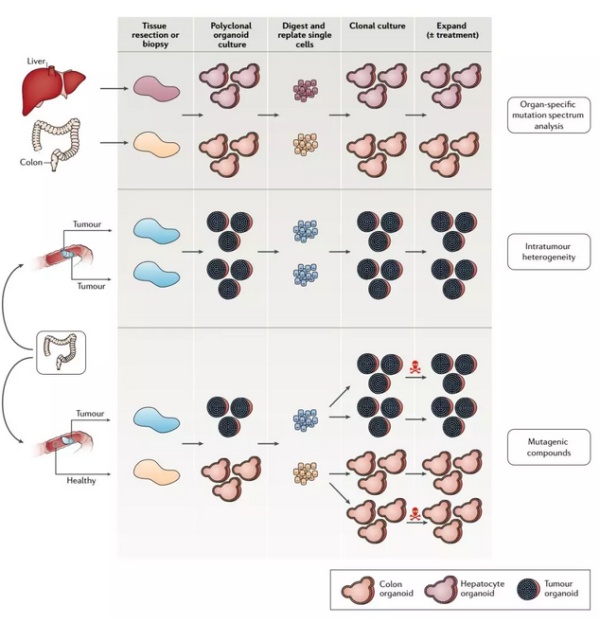
▲类器官能用来追踪肿瘤突变(图片来源:《Nature Reviews Cancer》)
其次,类器官能很好地帮助我们理解在肿瘤的发展过程中,突变如何出现和积累。类器官的一大好处在于,我们能同时建立起健康组织与肿瘤组织的模型。前者的遗传信息相对稳定,这也提供了极佳的对照。在发表于《自然》及其子刊的数篇论文中,科学家们发现类器官能帮助我们清楚地探明不同癌症所演化出的不同突变类型。这也能帮助我们找到针对不同突变的最佳疗法。
第三,类器官还可以直接从遗传学的角度建立肿瘤病发的模型。同样是来自《自然》及其子刊的两篇论文表明,我们可以先建立健康人类的类器官模型,再辅以 CRISPR-Cas9 基因编辑技术,我们可以确认结直肠癌的病因包括了 KRAS 的异常激活,以及 APC、TP53、或是 SMAD4 的失活。当然,在这一应用方向上,类器官还面临着一些挑战——由于缺乏肿瘤微环境,这些肿瘤类器官很少表现出转移的态势。这势必会限制我们对癌症转移的研究。
后记
限于篇幅,我们无法将这篇综述的方方面面分享给读者。感兴趣的朋友们可以点击本条药明康德微信文章最下方的“阅读原文”,访问原始论文页面。
总结来说,作者们认为类器官的挑战与机遇并存。诚然,类器官自身有着不少局限,譬如目前的类器官培养环境中尚未考虑基质与血管的影响。另外,由于肿瘤类器官容易出现细胞分裂的错误,它们在体外的培养速度往往不如健康组织的类器官。这也给两者之间的比较带来的挑战。
除了这些局限外,作者们相信类器官正在成为研究癌症的好帮手。我们能高效地建立这些模型,并针对每一名患者寻找和开发个体化的疗法。如果我们能进一步优化类器官平台上的新药筛选流程,无疑将更快、更好地把个体化疗法带向临床。
参考资料:
[1] Organoids in cancer research
[2] CHD1 loss sensitizes prostate cancer to DNA damaging therapy by promoting error-prone double-strand break repair.
[3] Genome sequencing of normal cells reveals developmental lineages and mutational processes
[4] Tissue-specific mutation accumulation in human adult stem cells during life
[5] Signatures of mutational processes in human cancer
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。



{replyUser1} 回复 {replyUser2}:{content}