39 家医院联合发文 实验证实槐耳颗粒可降低肝癌术后复发率
凡事非黑即白,肯定不是一种绝对正确的世界观,毕竟这个世界又不是由一道道判断题组成的……50% 的答对几率,瞎蒙都能蒙对不少,多幸福啊。这些年各种各样的反转大戏层出不穷,就连奇点糕这种判断力不错的人也偶尔会被带到沟里……用辩证思维和科学态度就事论事,才是最好的答案。
 所以啊,就算是这些年没少招黑的中草药,也不要一棍子打死。在上周的英国胃肠病学会会刊 Gut 上,39 家中国三甲医院共同组织的一项大规模临床试验证实:由药用真菌槐耳制成的中药槐耳颗粒,能显著降低肝癌切除术后患者的复发率,有望填补肝癌缺乏有效辅助疗法的空白 [1]!
所以啊,就算是这些年没少招黑的中草药,也不要一棍子打死。在上周的英国胃肠病学会会刊 Gut 上,39 家中国三甲医院共同组织的一项大规模临床试验证实:由药用真菌槐耳制成的中药槐耳颗粒,能显著降低肝癌切除术后患者的复发率,有望填补肝癌缺乏有效辅助疗法的空白 [1]!
槐耳的“生活照”其实看着也挺平淡无奇的……
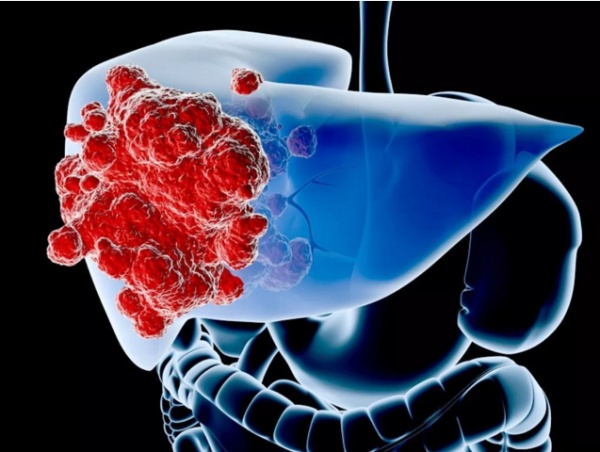
奇点糕还是实习小医生一枚的时候,印象最深的患者,几乎都和肝癌这个大魔头脱不了干系:年轻母亲生下可爱的双胞胎不久就被确诊癌症晚期,家中栋梁硬撑着疼痛许久不治被家人送来医院,老人头晕发作摔倒,结果是巨大肝癌破裂出血所致……在中国这个肝癌大国,这种悲剧每天都在上演。
就算是面对早期患者,外科大佬们往往也眉头紧锁。虽然手术切除是治疗肝癌最好的选择,但切除手术后的复发率能高达 40-70%[2],比肺癌还要可怕!而且医生们对肝癌复发也没有什么预防的高招,化疗放疗消融栓塞都预防无力,只能复发时上阵 [3],曾是肝癌唯一靶向药物的索拉非尼也派不上用场[4]。
奇点糕上阵过的肝癌手术,基本上看到的都是已经硬化的不像样子的肝……整个癌变只是时间问题,手术切除和做移植预后也很糟糕
由欧洲肝脏研究学会(EASL)和欧洲癌症治疗研究组织(EORTC)编写的权威指南,直白地点明了医学界的无奈:“在临床实践中,不推荐化疗、栓塞、消融、免疫治疗等手段作为肝癌术后预防复发的辅助治疗策略,但仍然期待有大规模临床试验进一步研究相关问题。”[5]
现代医学暂时攻不破的难题,传统医学里会不会有答案呢?青蒿素抗疟疾的故事相信大家都不陌生,而本次论文的主角槐耳也有着与青蒿素相似的 1600 多年药用史。早在东晋年间的《肘后备急方》中,就有“治肠痔下血:槐树上木耳,为末,饮服方寸匕,日三服”的记载,《唐本草》中首次见到了槐耳一名 [6]。
不知怎么的,看到槐耳竟然有点儿食欲……
槐耳的抗癌功效被发掘,要追溯到上世纪 80 年代,上海肿瘤医院(现复旦大学附属肿瘤医院)接诊的一位晚期肝癌患者,他在住院期间拿乡亲所赠的槐耳冲液然后服用,一年多后症状竟然完全消失!
这一现象引起了南京中医药大学专家的兴趣,经过一系列调查考证、药物研发和临床试验,槐耳颗粒于 1992 年获批用于晚期肝癌治疗,成为中药史上唯一基于真菌生产的药物 [6]。那么槐耳颗粒能不能再建新功,用于肝癌术后患者呢?
在华中科技大学同济医院的陈孝平院士牵头组织下,全国 39 家三甲医院共同开展了本次的大规模临床试验,共在 2011-2014 年间招募到 1002 名接受了欧美标准肝癌根治术 [5,7] 的术后患者,按 2:1 的比例分别口服槐耳颗粒(每日三次,每次 20 克)治疗和作为空白对照组。
本次论文的通讯作者,同济医院肝胆外科大牛陈孝平院士
本次试验主要分析的是槐耳颗粒对降低术后复发率是否有帮助,因此主要终点设定为了无复发生存期(RFS),即从手术后到癌症出现复发或患者因各种原因死亡的时间,此外还对总体生存期、肝外转移和复发率、安全性等指标进行了统计。
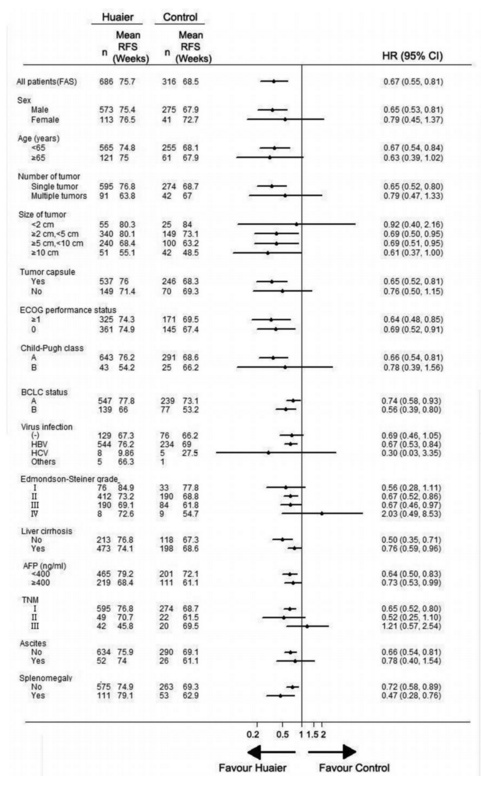
研究的随访为期 24 个月,而槐耳颗粒果然体现了出色的效果:实验组患者与对照组的癌症复发率分别是 37.6% 和 50.9%,足足相差了 13%!在无复发生存期上,实验组患者平均为 75.5 周,比对照组相对延长了 33%。不管患者开始服药时是否存在乙肝感染、肝硬化、腹水等情况,槐耳颗粒的效果都相当稳定。
图上体现了槐耳颗粒与对照组相比,治疗不同状况患者的效果,除了少数中晚期患者和肝功能不佳的患者,槐耳颗粒的效果都相当出色,可以说是通吃
在总体生存期方面,由于随访时间还相对较短,两组患者生存率都超过了 90%(95% 对 91%),但计算相对值的话,槐耳颗粒治疗仍然使患者的死亡风险相对下降了 44.7%。治疗的安全性也相当良好,不良事件发生率两组相近,只有不足 2% 的患者中途停药。
稍显遗憾的是,本次试验并没有以安慰剂进行对照。研究团队在论文中表示,这是由于槐耳颗粒的苦味明显,容易分辨,因此难以制出能以假乱真的安慰剂。至于随访时间问题,研究团队认为,短期内肝癌治疗出现新的突破可能性极小,将来统计患者的 5 年生存率时,槐耳颗粒组应该仍然有明显的优势。
虽然已经不在治病救人的一线,但奇点糕一直都记得,入学时候高举右手宣下的希波克拉底誓言。医者父母心,能多让一个患者活下来都应该是努力的目标,不是吗?管它中药西药,只要明确证实有效就是好药!
参考资料:
1.Chen Q, Shu C, Laurence A D, et al. Effect of Huaier granule on recurrence after curative resection of HCC: a multicentre, randomised clinical trial[J]. Gut, 2018: gutjnl-2018-315983.
2.Portolani N, Coniglio A, Ghidoni S, et al. Early and late recurrence after liver resection for hepatocellular carcinoma: prognostic and therapeutic implications[J]. Annals of Surgery, 2006, 243(2): 229.
3.Poon R T P, Fan S T, Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma[J]. Annals of Surgery, 2000, 232(1): 10.
4.Bruix J, Takayama T, Mazzaferro V, et al. Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial[J]. The Lancet Oncology, 2015, 16(13): 1344-1354.
5.European Association For The Study Of The Liver. EASL–EORTC clinical practice guidelines: management of hepatocellular carcinoma[J]. Journal of Hepatology, 2012, 56(4): 908-943.
6. 庄毅, 陈慎宝, 陆正鑫. 中药 (菌物药) 与肿瘤(槐耳颗粒剂的新药研发、生产及其后继研究)[C]// 首届全国中医肿瘤高峰论坛. 2012.
7.Marrero J A, Kulik L M, Sirlin C, et al. Diagnosis, Staging and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases[J]. Hepatology, 2018.

来源:生物360
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。




{replyUser1} 回复 {replyUser2}:{content}