《细胞》子刊:双合成致死疗法或可彻底清除特定癌细胞
许多癌症与细胞自我修复机制出现故障有关。名为BRCA(BReast CAncer susceptibility gene)的蛋白质在细胞修复DNA损伤的过程中起关键作用,它突变时会促进癌症发展。如果在癌细胞中禁用BRCA修复系统,它们有可能转向备用修复机制,借此逃避靶向药物治疗。
近来,美国费城天普大学(Temple University)路易斯卡茨医学院(LKSOM)的科学家们发现,同时使用两种靶向疗法,双管齐下进行治疗,可以消除癌细胞至少两种备用修复机制。这种治疗策略有效地减少了癌细胞可用的修复途径,有助于消灭癌细胞。描述这种双合成致死性(dual synthetic lethality)的论文发表在近日的《细胞》子刊《Cell Reports》上。

BRCA基因产生的蛋白质参与DNA修复。当其发生突变,变成缺陷型时,DNA修复就可能无法正常进行,导致某些类型癌症(如乳腺癌和卵巢癌)的发生。BRCA突变可以是遗传性(生殖细胞)或自发性(体细胞)。BRCA基因突变约占遗传性乳腺癌的25%至30%,和所有乳腺癌5%至10%。据估计,约72%的具有遗传性BRCA1突变的人,和约69%的具有BRCA2突变的人,会在80岁前患上乳腺癌。而在每年约2.2万多名被诊断为卵巢癌的女性中,大约15%至20%的患者携带BRCA基因突变。
BRCA蛋白主要修复DNA单链损伤,并且起维持细胞遗传稳定性的重要作用。具有BRCA缺陷突变的癌细胞通常是依赖于聚ADP-核糖聚合酶1(PARP1)蛋白介导的DNA修复。PARP是细胞中另一种重要的DNA修复蛋白,主要修复DNA双链损伤。BRCA突变型癌细胞由于BRCA失活,DNA修复非常依赖于PARP,倘若PARP活性进一步受到抑制,这些细胞分裂时就会产生大量无法修复的DNA损伤,导致癌细胞死亡。临床上,PARP1抑制剂可显著提高患有遗传性BRCA突变的癌症患者的无进展存活期。
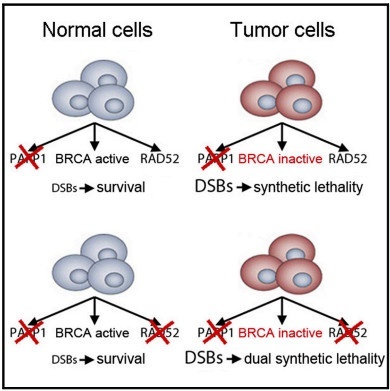
▲用PARP和RAD52抑制剂组合疗法在BRCA缺陷型肿瘤中发挥双重合成致死效应(图片来源:Cell Report)
然而,随着时间的推移,PARP1抑制剂的有效性会下降,患者最终出现癌症复发。据本论文资深研究员, 微生物及免疫学教授Tomasz Skorski博士介绍,癌细胞有多种保护自己免于死亡的方式,PARP1抑制剂会失效,是因为只靶向一种DNA修复途径是不够的。“肿瘤细胞最终通过激活BRCA介导的另一个备份修复途径来逃避PARP1抑制,” Skorski博士说:“我们以前的研究表明,RAD52修复途径是一条潜在的逃避路线,所以我们同时抑制PARP1和RAD52,来看是否能引发对癌细胞更有效的杀伤力。”
Skorski博士的团队首先在具有BRCA缺陷型的实体瘤和白血病细胞系中进行了一系列体外实验。他们使用一种在研RAD52抑制剂,证明了RAD52抑制剂能增强PARP抑制剂olaparib的抑癌作用。Olaparib是美国FDA批准的首个PARP抑制剂,用于治疗部分卵巢癌和乳腺癌等多种癌症,它也是首个有潜力利用DNA损伤应答(DDR)通路缺陷(如BRCA突变),来优先杀死癌细胞的靶向疗法。这项研究的结果显示,对于所有肿瘤类型,RAD52抑制剂加olaparib的双重抑制疗法彻底清除了BRCA缺陷型肿瘤细胞!

然后,研究者在小鼠中针对BRCA缺陷型肿瘤测试了双重抑制疗法的效果。小鼠试验的结果与体外细胞系试验的结果类似。研究者发现,双重抑制疗法在体内对肿瘤具有强烈的作用,并显示出比任何单一疗法更高的活性。
重要的是,体外和体内试验的结果都表明,具有正常BRCA活性的健康细胞并不受双重抑制的影响!“正常细胞继续使用BRCA介导的修复途径作为主要DNA修复途径,并不会特别依赖PARP1或RAD52,” 该论文第一作者,博士生Katherine Sullivan-Reed解释说。不对正常细胞造成太大伤害的疗法,有助于降低患者使用靶向治疗时可能出现的副作用严重程度。
这项新研究显示,对肿瘤患者进行BRCA缺陷型基因测序筛选,并为其开发一种能抑制RAD52的药物来与PARP抑制剂同时使用,有望成为一种行之有效的治疗策略。Skorski博士的团队计划继续研究其他DNA修复途径,希望通过调控这些途径对BRCA缺陷型肿瘤细胞造成重大后果,但正常细胞却不会受到太大影响。 “我们的主要目标之一是找到能杀死癌细胞的额外目标,而不增加对正常细胞的毒性。” Skorski博士补充说。
我们祝贺Skorski博士的团队,希望这一发现能带来有效的新药,通过靶向细胞修复途径来帮助患者杀死癌细胞。



{replyUser1} 回复 {replyUser2}:{content}