《Nature》:CRISPR 基因编辑时代 DNA 修复的秘密
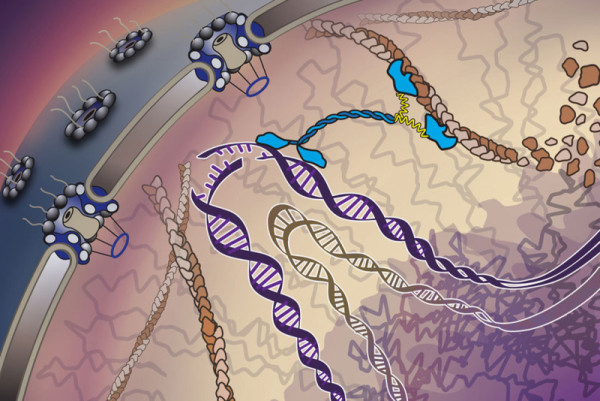
“行走分子”拾起了受损 DNA,然后将其运送至“核孔急诊室”。
CRISPR-Cas9 本来是细菌用来抵御病毒的免疫工具。过去几年,研究人员发现这套系统也可以相对精确地定向修改哺乳动物和植物等生物的基因。世界各地涌现出大量研究开始关注 CRISPR-Cas9 在衰老和疾病(如癌症)等领域的潜在应用。
在科学家们还未透彻地阐明 DNA 损伤和修复的意义和影响之前,基因组编辑时代已然到来。上周,《Nature Medicine》就报道了 CRISPR-Cas9 基因编辑技术因 DNA 剪切可能导致 p53 蛋白激活,从而引发细胞无限增殖和癌变。因此,我们迫切需要更深入地理解应对 DNA 链断裂细胞采取了哪些进程。
本周, 南加州大学 Irene Chiolo 课题组在《Nature》 发表文章 ,他们利用荧光标记示踪了果蝇和小鼠细胞在 DNA 受损后发生了哪些具体事件。
细胞如何从紧密堆积的异染色质(heterochromatin)中捞出被破坏的 DNA 链,然后紧急修补?这篇文章指出,细胞有一支专业的“护理团队”和一间“急诊室”用来急救和修补受损 DNA。
“异染色质也被称为‘基因组的暗物质’,我们对它知之甚少,”Chiolo 说。“但是,我们有理由认为异染色质的 DNA 损伤可能是癌症形成的主要驱动力。”
大约 20 年前,这些重复的 DNA 序列曾被称为“垃圾 DNA”。从那时起,越来越多研究表明,重复 DNA 序列影响许多重要的核活动,它们的修复缺陷也与衰老和疾病有关。
“异染色质主要由重复的 DNA 序列组成,”Chiolo 说。“但是低基因含量让这些序列看起来并不起眼。”
事实上,损害异染色质修复的突变会导致大量的染色体重排,波及整个基因组。
科学家们发现,DNA 链断裂后,细胞会促使一系列丝状核肌动蛋白(nuclear F-actin)纤维搭建一条通往细胞核边缘的临时高速公路,接下来,以肌球蛋白(myosins)为代表的护理人员正式登场。“肌球蛋白是一种行走分子,它有两条腿,两条腿交替行走。它就像一个分子机器人沿着肌动蛋白丝到处走动。”
研究人员观察到,肌球蛋白拾取受损 DNA,然后沿着“丝路”走进位于核室外围一个被戏称为“急救室”的孔内。
“根据我们以前的研究,我们知道核孔内有一个急救室,细胞在那里处理和修复破损 DNA 链。现在,我们搞清楚了受损 DNA 如何到达那里。”Chiolo 说。“我们认为,损伤触发了一个防御机制,该机制迅速用肌动蛋白纤维建立一条通道,同时开启作为救护车的肌球蛋白。”
原文:Nuclear F-actin and myosins drive relocalization of heterochromatic breaks
DOI号:10.1038/s41586-018-0242-8
来源:序说DNASpeaking
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}