《Nature》子刊:“魔剪”CRISPR改善了自闭症小鼠行为
 科学家们采用CRISPR-Cas9基因编辑系统减轻了患有脆性X染色体综合征(fragile X syndrome,FXS)小鼠的部分自闭症症状。FXS被认为是单基因导致的自闭症谱系障碍(ASD)的最常见原因。
科学家们采用CRISPR-Cas9基因编辑系统减轻了患有脆性X染色体综合征(fragile X syndrome,FXS)小鼠的部分自闭症症状。FXS被认为是单基因导致的自闭症谱系障碍(ASD)的最常见原因。
加州大学伯克利分校开发的利用纳米金颗粒递送Cas9酶入脑切割DNA技术(该技术被简称为CRISPR-Gold)允许研究人员对FXS小鼠的神经递质受体基因进行编辑,有效减少了动物重复特定行为的病症。文章发表在6月25日的《Nature Biomedical Engineering》杂志。
夸张的重复行为是ASD的共同特征,CRISPR-Gold在FXS小鼠模型中展示出的效果预示着这种技术对其他已知遗传原因的自闭症类型的潜在应用。
“目前,自闭症尚处于无药可治阶段,许多蛋白靶向药物的临床试验都告以失败,”德州大学健康科学中心细胞和综合生理学助理教授Hye Young Lee说。“我们第一次用CRISRP编辑大脑自闭症相关基因获得成功,结果显示行为症状可以得到缓解。”
相比使用病毒作为载体,CRISPR-Gold有很多优点。“这篇论文令人信服之处在于,Hye Young证明了将CRISPR-Gold注入脑内,致病基因不仅真的被敲除了,而且还观察到相当显著的行为改变,”加州大学伯克利分校生物工程教授、CRISPR-Gold的发明人Niren Murthy说。“世界上第一次有人用非病毒呈递介质做到了这一点。”
该论文首次指出,Cas9蛋白可以转运入脑、敲除基因,并具有治疗作用。为了编辑神经元基因,其他研究人员通常使用腺相关病毒来呈递Cas9基因。但是,这样做的问题在于基因持续表达Cas9酶容易引发其他基因的随机切割。相反,CRISPR-Gold本身携带Cas9复合体(包括纯化的Cas9蛋白和导向RNA)直接进入细胞,完成切割使命后就会自行消失。
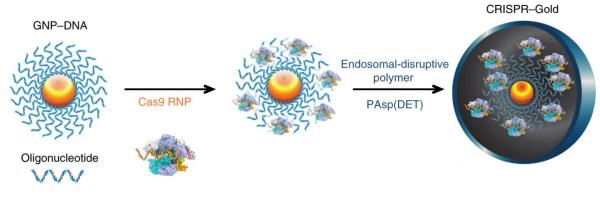
“如果你用病毒注射CRISPR DNA,你无法控制Cas9和导向RNA的表达量,”Lee说。“CRISPR-Gold方法很酷,我们可以控制我们想要的注射量,从而最小化CRISPR的副作用。”
这项技术为治疗阿片类药物成瘾、神经病理学疼痛、精神分裂症和癫痫发作等疾病提供了可行方案。
抑制过度兴奋的大脑
研究人员向FXS小鼠大脑纹状体(striatum)中注射CRISPR-Gold,已知纹状体介导习惯形成,是ASD重复行为的相关脑区。Cas9的靶点是一个名为代谢型谷氨酸受体5(metabotropic glutamate receptor 5,mGluR5)的兴奋性受体。通过禁用mGluR5基因,细胞之间的夸大信号得到抑制,小鼠重复行为有所减少:挖掘行为减少30%,跳跃行为减少70%。纹状体内大约50%的mGluR5基因被成功编辑,受体蛋白数量减少将近一半。
“在实验之前,我们并不知道纹状体mGluR5受体是否真正参与夸张的重复行为,这项研究帮我们找到了一个重要的生物学新发现,”Lee说。
制药公司曾尝试将小分子药物注射到血液系统以阻断相同受体,小鼠很快就会对随后的治疗不再反应(耐药)。
去年,Murthy和同事证明,CRISPR-Gold可以携带Cas9进入肌肉细胞,将一种突变基因替换为正常基因,提高了Duchenne型肌营养不良小鼠的肌肉力量。
新论文证明,CRISPR-Gold还可作用于多种脑细胞。
“我们在本篇论文中也展示了CRISPR-Gold编辑其他非神经元细胞的能力,比如小胶质细胞和星形胶质细胞,”Murthy说。“事实上,用CRISPR-Gold编辑这些细胞比编辑神经元的效率更高。”
“CRISPR-Gold可以用于治疗多种遗传疾病,如亨廷顿氏病,”Lee说。“它并不局限于单基因疾病,一旦我们透彻地阐明整个基因网络,它也可以用于多基因疾病。”
Hye Young Lee、Kunwoo Lee(GenEdit公司CEO、加州大学伯克利分校教授)和Murthy目前正在开发通过脊髓直接注射到中枢神经系统的CRISPR-Gold粒子,以避免开颅手术。


{replyUser1} 回复 {replyUser2}:{content}