梅奥科学家发现清除体内衰老细胞能够有效减缓衰老及老年疾病
科幻小说家畅想了人类未来可能发生的一切,而这一切正在成为一场自证预言。试管婴儿、人造卫星以及互联网等这些曾经出现在科幻小说里的故事如今都成为了现实。不得不承认,科学技术正在以几何倍数不断飞速发展,著名的科学家、《奇点迫近》的作者雷蒙德·科兹威尔曾大胆预言人类“长生不老”的梦想终将实现。
虽然时至今日,人类都无法逃避死亡的命运,但如果了解衰老机制可能有助于预防或逆转与衰老相关的疾病、延长健康寿命。
经过科学家们的努力探索,衰老背后最重要的生物过程被揭开,那就是细胞衰老,同时他们发现衰老细胞积累与老年慢性疾病密切相关。因此,清除衰老细胞来延缓衰老并预防老年慢性疾病引起了科学家们的广泛关注。
 衰老细胞
衰老细胞
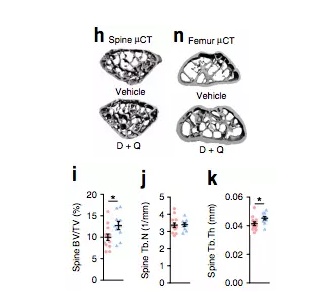
最近,美国梅奥医学中心的研究人员使用他们开发的“senolytic”药物靶向清除“老龄”鼠衰老细胞,发现能够减少骨吸收(破骨细胞分解骨的过程),维持或增加骨形成,最终使其骨量增加、骨质增强,预防与衰老相关的骨质疏松。这项最新研究发表在近期的《Nature Medicine》中。
同时,研究人员表示,他们开发的“senolytic” 药物,不但能够有效清除机体衰老细胞,而且不会对正常细胞产生影响。如果这些药物在人体中被证明是有效且安全的,那么它们可能预防或延缓一系列与衰老相关的疾病,并在衰老领域产生“变革”!
众所周知,为了维持机体健康,体内大多数细胞都会持续分裂,以替换老化和损伤的组织,但细胞最终衰老,脱离细胞周期,停止分裂并抵抗凋亡。这些停止正常分裂的细胞被称为衰老细胞。
衰老细胞功能衰退、代谢低下,对促有丝分裂刺激的反应力减弱,促凋亡因素的反应性改变,不能促进组织修复,同时还可分泌炎性蛋白来破坏或损伤周围健康细胞的功能[2]。
而且,随着时间的推移,不断积累的衰老细胞会对周围组织产生破坏,与自然机体衰老特征直接相关。这一系列过程会导致器官功能障碍并促进与衰老相关疾病的发展,如癌症、心血管疾病、中风、痴呆、运动障碍、骨关节炎、骨质疏松以及代谢性疾病等。
为了解驱使机体衰老的因素,最终阻止或逆转与衰老相关的疾病并延长健康生命。美国梅奥医学中心Robert 和 Arlene Kogod老年中心启动了一项大型的细胞衰老计划。该计划的重点领域包括清除功能紊乱的衰老细胞、抑制衰老细胞分泌有毒因子的释放、干扰促进衰老的途径等。
目前该计划已经取得了丰硕的科研成果,在一些预临床试验中通过清除鼠衰老细胞延迟了与衰老相关疾病的发展。纽约时报称这一计划是“基因工程的微妙壮举”。
 细胞衰老计划
细胞衰老计划
该计划的研究人员基于RNA和衰老细胞蛋白表达谱的生物信息学方法,识别了5个衰老细胞的抗凋亡通路(SCAPs),在这个途径中,衰老细胞通过促生存途径来防御自己促凋亡,因此生存蛋白被认为是衰老细胞的致命弱点,敲除表达生存蛋白的基因可使衰老细胞凋亡,但不会对正常细胞产生影响。
据此,梅奥医学中心于2015年研发了首例清除衰老细胞的“senolytic”药物。从那之后,研究人员不断筛选优化,开发出一系列靶向SCAPs通路的 “senolytic”药物。
2016年2月,他们发表在《Nature》上的研究证实[3],清除衰老细胞可延长雌鼠和雄鼠的平均寿命(平均寿命增加了17%-35%),延迟肿瘤发生,减缓与衰老相关的器官退化,如肾脏和心脏等,且无明显副作用。
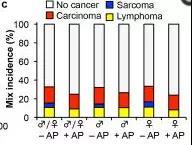 结果显示,清除体内衰老细胞(+AP)组肿瘤发生率下降
结果显示,清除体内衰老细胞(+AP)组肿瘤发生率下降
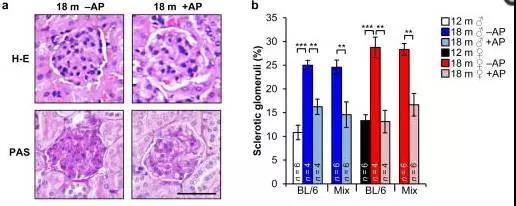 清除体内衰老细胞(+AP)组显著降低了肾小球硬化
清除体内衰老细胞(+AP)组显著降低了肾小球硬化
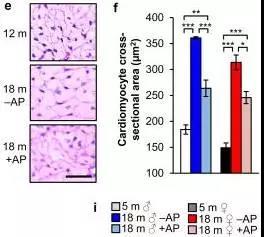 心肌细胞肥大是心脏衰老的特征,清除体内衰老细胞(+AP)组心肌细胞较小
心肌细胞肥大是心脏衰老的特征,清除体内衰老细胞(+AP)组心肌细胞较小
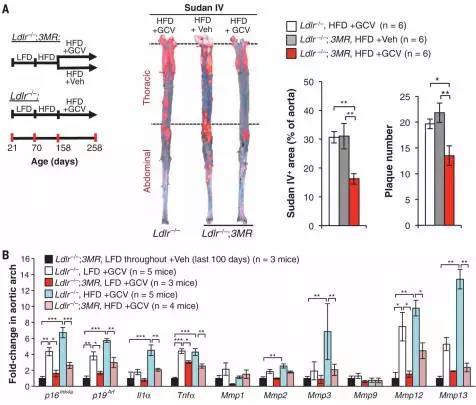
2016年8月,研究人员发表在《Science》上的研究以动脉粥样硬化的小鼠为模型,用“senolytic”药物清除小鼠体内的衰老细胞来验证衰老细胞在不同阶段动脉粥样硬化疾病中的作用。
研究结果发现在动脉粥样硬化起始阶段,带有衰老标记的巨噬细胞在血管内皮积聚,通过增加炎性细胞因子和趋化因子的表达来驱动动脉粥样硬化形成的病理过程。而在晚期病变中,衰老细胞通过增加金属蛋白酶的产生,促进斑块不稳定特征,包括弹性纤维的降解和纤维帽的细化。
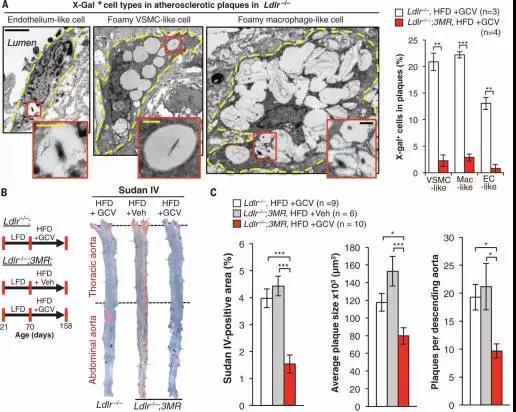 衰老细胞驱动了动脉粥样硬化的形成
衰老细胞驱动了动脉粥样硬化的形成
 在已建立的斑块模型中去除衰老细胞干扰了动脉粥样硬化的微环境
在已建立的斑块模型中去除衰老细胞干扰了动脉粥样硬化的微环境
因此证实衰老细胞是动脉粥样硬化形成的关键因素,选择性地清除衰老细胞是治疗动脉粥样硬化的保证。
2017年6月,该研究组的科学家为了验证衰老细胞可能在骨关节炎中起决定性作用,使用p16-3MR转基因鼠(使得衰老细胞在体内可视化)研究发现,鼠前交叉韧带断裂(ACLT)后,衰老细胞在关节软骨和滑膜中聚集,关节内注射“senolytic”药物后,通过选择性清除衰老细胞延缓了创伤后骨关节炎的发展,减少疼痛并增加软骨发育,因此证实将衰老细胞作为治疗靶点可治疗退行性关节疾病。该研究同样发表在《Nature Medicine》中[6]。
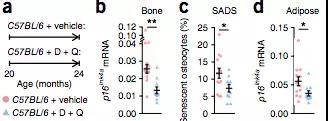
这次,研究人员在清除衰老细胞预防骨质疏松的研究中[1],使用3种方法靶向20-22个月老鼠(相当于人70岁高龄)的衰老细胞。三种方法包括:可以杀死衰老细胞的基因模型(使用药物激活基因来清除衰老细胞)、使用梅奥诊所先前开发的用于清除衰老细胞的“senolytic”药物以及Janus激酶抑制剂,用于阻止Janus激酶活性的药物,消除衰老细胞产生的有毒物质。
 使用“senolytic”药物(D+Q)清除衰老细胞
使用“senolytic”药物(D+Q)清除衰老细胞
 实验组骨量增加,骨微架构良好
实验组骨量增加,骨微架构良好
随机对照试验结果显示,这三种方法均通过清除衰老细胞减少骨吸收(在骨吸收的过程中,活跃的破骨细胞将会分泌酸性物质和酶,对矿化的骨基质进行分解吸收,使得该区域的骨量发生下降)、维持或增加骨形成,增加了小鼠的骨量和骨强度,预防与衰老相关的骨质疏松。
 梅奥医学中心Robert 和 Arlene Kogod老龄化研究中心主任James Kirkland博士
梅奥医学中心Robert 和 Arlene Kogod老龄化研究中心主任James Kirkland博士
梅奥医学中心Sundeep Khosla医学博士表示,这项研究在骨领域的新奇之处就在,它不像目前治疗骨质疏松的方法一样靶向骨特异性通路,而是靶向一个基本衰老过程,不仅能改善骨骼质量,还能预防其他与衰老有关的疾病。
梅奥医学中心Robert 和 Arlene Kogod老龄化研究中心主任James Kirkland博士说,过去几年的研究中我们发现类似 “senolytic” 的药物越来越多,接下来我们将继续测试是否有更多的靶向衰老细胞的药物或通过药物组合来扩大靶向衰老细胞的类型。我们的目标是在人体试验中取得和预临床动物实验同样的成功,努力预防或延缓与衰老相关的疾病!


{replyUser1} 回复 {replyUser2}:{content}