CRISPR出现新隐患 张锋等人公司股价暴跌 最高跌去10亿!
CRISPR-Cas9有望成为临床背景下的基因编辑工具。 到目前为止,Cas9诱导的遗传改变的探索仅限于靶位点和远端脱靶序列附近,这就得出了导致CRISPR-Cas9具有合理特异性的结论。
2018年7月16日,英国Wellcome Sanger 研究所Bradley研究组在Nature Biotechnology在线发表题为“Repair of double-strand breaks induced by CRISPR–Cas9 leads to large deletions and complex rearrangements”的研究论文,该研究报告了显著的靶向诱变(例如小鼠胚胎干细胞,小鼠造血祖细胞和人分化细胞系中靶向位点的大缺失和更复杂的基因组重排)。 使用长读取测序和长程PCR基因分型,显示由单指导RNA / Cas9引入的DNA断裂经常解析为延伸超过许多千碱基的缺失。
此外,确定了切割部位远端的突变和交叉事件。 由CRISPR-Cas9编辑引起的有丝分裂活性细胞中观察到的基因组损伤可能具有致病后果。
然后我们发现,张锋等人的Editas股价暴跌,最大幅度接近10%,现在又有少许的拉升。瞬间10个亿没有了,(3.37x0.4720x6.72=10.68亿,3.37是最大跌幅,0.4720是股本,6.72是汇率)。

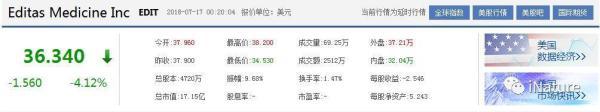 张锋Editas公司股票
张锋Editas公司股票
CRISPR-Cas9系统用于人类基因治疗的效用已得到认可和广泛研究。通过开发敏感检测方法以及改进的Cas9酶和改进的限制此类损害的递送方案,解决了对脱靶活性的初步担忧。 Cas9切割后在各种细胞类型中绝大多数的靶向DNA修复结果被认为是小于20bp的插入和缺失(插入缺失)。虽然在使用Cas9或其他核酸酶的实验中也观察到大小数百个核苷酸的插入缺失,但据报道它们是罕见的。
使用配对的gRNA诱导局部缺失的研究也报道了更复杂的基因型的产生,例如倒位,内源和外源DNA插入,以及大于预期的缺失。单个gRNA显示在小鼠受精卵中诱导高达600bp的缺失。已经描述了可能由单个gRNA诱导的单倍体癌细胞系中高达1.5kb的缺失。此外,在大多数研究中,使用单一和成对gRNA产生的等位基因的分析依赖于靶标周围和潜在脱靶位点的短区域(<1kb)的扩增,限制了评估范围。与切割位点不相邻的病变,例如在I-SceI核酸酶切割时在酵母中报道的病变,也会被这种短程评估错过。最后,其基因组和DNA修复机制异常的癌细胞系经常用于研究Cas9诱导的病变,使得对正常组织和细胞的外推成为问题。
基于以上问题,英国Wellcome Sanger 研究所Bradley研究组报告了显著的靶向诱变,例如小鼠胚胎干细胞,小鼠造血祖细胞和人分化细胞系中靶向位点的大缺失和更复杂的基因组重排。 使用长读取测序和长程PCR基因分型,Bradley研究组显示由单指导RNA / Cas9引入的DNA断裂经常解析为延伸超过许多千碱基的缺失。 此外,确定了切割部位远端的病变和交叉事件。 由CRISPR-Cas9编辑引起的有丝分裂活性细胞中观察到的基因组损伤可能具有致病后果。
本研究中的编辑是在正常ES细胞和祖细胞中的活跃转录基因座上进行的,两者都具有完整的DNA修复过程,以及永生化的分化的人细胞系;每个都是各种临床编辑应用的细胞系。Bradley研究组表明,广泛的靶向基因组损伤是所有基因座和所有测试细胞系的共同结果。此外,观察到的遗传后果不仅限于目标基因座,因为诸如杂合性丢失之类的事件将揭示隐性等位基因,而易位,倒位和缺失将引起远程转录后果。
鉴于目标基因座可能具有转录活性,将其与数百种癌症驱动基因之一并列的突变可能会引发肿瘤形成。在编辑数十亿个细胞的临床背景下,产生的大量不同突变使得每个方案中的一个或多个编辑细胞可能被赋予重要的致病性病变。这种病变可能构成干细胞和祖细胞中的第一次致癌过程,其具有长的复制寿命并且随着时间的推移可能变成肿瘤。这种情况类似于在一些早期基因治疗试验中通过前病毒插入激活LMO2,这些试验在这些患者中引起癌症。此处报道的结果还说明了在离体进行编辑时需要彻底检查基因组。由于遗传损伤是常见的,广泛的,并且通过常用的短程PCR检测不可检测,因此需要进行全面的基因组分析,以便在患者给药前鉴定具有正常基因组的细胞。
来源:iNature
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}