《Nature》&《Science》同时聚焦线粒体钙单向转运通道蛋白!
2018年7月12日,Nature杂志在线online了三篇研究长文,报道了线粒体钙单向转运蛋白(mitochondrial calcium uniporter ,MCU)的结构与功能;加上前一周在Science杂志online的一篇,四篇文章系统的阐述了真菌中MCU的分子生物学机制【1-4】。笔者梳理了一下相关文章的异同,并附上通讯作者的简介,与读者共享。
线粒体Ca2+转运对于调节ATP产生,细胞内钙信号转导,调节能量代谢,产生活性氧物质和调节细胞死亡至关重要,在线粒体生理学和病理生理学中扮演着重要角色。线粒体钙单向转运蛋白——MCU是一种高选择性钙离子通道,位于线粒体内膜,是钙离子进入线粒体基质中的主要介质【5】。此前,MCU通道是如何催化离子渗透并实现离子选择性的分子机制尚不清楚,部分原因在于MCU被认为与其他细胞通道相比具有独特的结构。这四篇文章对分子机制的阐明迈出了重要一步。

原文:Cryo-EM structures of fungal and metazoan mitochondrial calcium uniporters
 原文: Cryo-EM structure of a fungal mitochondrial calcium uniporter
原文: Cryo-EM structure of a fungal mitochondrial calcium uniporter

原文: X-ray and cryo-EM structures of the mitochondrial calcium uniporter

原文:Cryo-EM structure of a mitochondrial calcium uniporter
四篇文章分别来自纪念凯特琳癌症中心、德克萨斯西南医学中心、斯坦福大学和哈佛大学、杜克大学和Scripps研究所(关于四篇文章的信息,详情见表1)。令人欣慰的是,通讯作者中四位华人科学家强强联合,贡献了其中两篇论文。
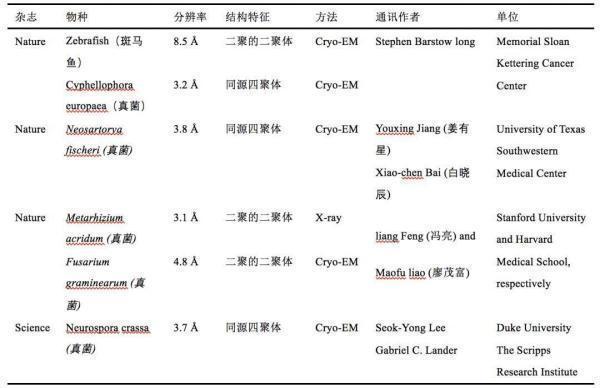
表1. 四篇文章的基本信息对比
对比这些文章,可以总结出一些异同点。原子分辨率或近原子分辨率的结构都来自真菌;真菌里面的结构显示为四聚体
(图1);主要是通过Cryo-EM方法解析。那么为什么会基本上都来自真菌呢?这是巧合吗?答案是:非也非也。
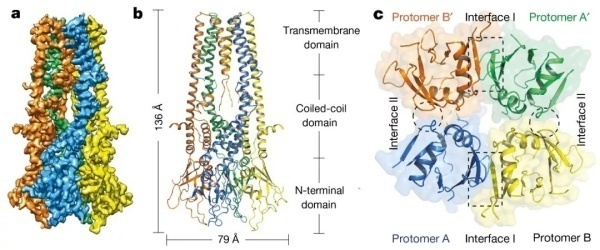
图1. NfMCU的Cryo-EM的电镜结构及四聚体示意图
在脊椎动物中,单向转运蛋白(uniporter)是一种蛋白质复合物,或叫“uniplex”。主要由四种成分组成:离子导电孔(MCU),辅助跨膜蛋白质必需的MCU调节亚基(essential MCU regulator, EMRE)【6】和外周膜门控蛋白(mitochondrial calcium uptake 1和2, MICU1和MICU2)【7】。EMRE在维持处于开放状态的MCU和招募MICU1/2方面发挥双重作用,MICU1/2以Ca2+依赖的方式调节MCU的活动。
虽然MCU存在于几乎所有的真核生物中,但是EMRE是后生动物特异性的。在大多数真菌中,基因序列分析表明MCU是uniporter的唯一组分【8】。功能诱变研究证明了来自真菌烟曲霉(Aspergillus fumigatus)的MCU直系同源物可以介导Ca2+转运到线粒体中,该MCU同源物能够在体内和体外自身重建通道活性【9,10】。这些研究表明MCU是单向的Ca2+导电孔形成单元,从而也开启了真菌MCU的结构生物学研究大门。
虽然此前已经报道了各种分离的MCU结构域,如人类MCU的NTD【11】,线虫MCU的N端结构域【12】,和人类MICU1的结构【13】,但是关于MCU通道如何装配,门控和离子渗透的基本机制仍然没有答案。
四篇文章对于机制的描述在细节上稍有区别,但总体结论一致。MCU的结构显示均为四聚体结构(图1),Ca2+的选择性主要是由保守的酸性氨基酸决定的。在MCU的序列中,存在着DXXE保守基序,DXXE序列位于跨膜区的α-螺旋,且在四聚体的中心位置,形成MCU独特的空隙(图2和图3);酸性氨基酸与Ca2+的配位作用,膜间空间的电负性表面,以及降低Ca2+流入线粒体的能量屏障决定了MCU的高度选择性(图3)。
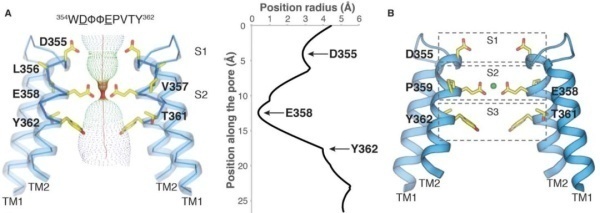
图2.保守的DXXE基序

图3.MCU选择Ca2+的模式图及生化实验验证结果
这四篇文章的结构解析,定义了在这个不寻常的通道中构成离子配位、渗透和钙选择性的原理(图3a),揭示了新的离子通道结构,提供了钙协调、选择性和传导的见解,并建立了理解线粒体钙单向转运功能机制的结构框架,为对通道组装,选择性钙渗透和抑制剂结合提供了的理论依据。
当然,虽然这些MCU结构揭示了uniporter的基本特征,但还需要进一步研究以解决关于后生动物uniporter功能的基本问题,例如后生动物MCU如何进化为需要EMRE进行离子传导,以及MICU1和MICU2是如何赋予Ca2+依赖性对uniplex进行门控调节;同时,也需要更高分辨率,各种状态以及与各组分的复杂结构,才能更详细的了解Ca2+选择性和门控通道的分子机制。
Stephen Barstow long博士简介

Stephen Barstow long博士本科毕业于Amherst College,获物理学学士学位;后就读于杜克大学,于2001年获生物化学博士学位;2001-2007年在洛克菲勒大学从事博士后研究,合作导师是Mackinnon R教授(离子通道研究领域的巨牛,2003年诺贝尔化学奖获得者)。 long博士目前任职于Memorial Sloan Kettering Cancer Center,主要运用Cryo-EM、X-ray和功能研究方法研究真核生物的离子通道、膜蛋白及膜融合的分子机制。主要研究领域包钙离子转运蛋白、氯离子通道蛋白、isoprenylcysteine carboxyl methyltransferase(ICMT)等。据不完全统计,Stephen Barstow long 博士目前以第一作者或通讯作者在CNS正刊发表文章超过9篇。(实验室主页:https://www.mskcc.org/research-areas/labs/stephen-long
Youxing Jiang (姜有星) 博士简介

Youxing Jiang (姜有星) 教授博士毕业于耶鲁大学,后在洛克菲勒大学从事博士后研究,合作导师也是Mackinnon R教授,与Stephen Barstow long博士是同事。姜老师目前是德克萨斯大学西南医学中心教授、霍华德休斯医学研究所研究员(HHMI)。主要研究领域是离子通道等膜蛋白,包括K+, Na+, Ca2+, and Cl-离子通道蛋白。主要结合使用X-ray、Cryo-EM,生物化学和电生理学等方法探测离子通道和转运蛋白的功能,控制离子在细胞膜上的流动,解析该离子通道的分子机制。目前已发表论文超过40篇,包括以第一作者或通讯作者的十余篇CNS正刊论文。(实验室主页:https://www.utsouthwestern.edu/labs/jiang-youxing/ )
Xiao-chen Bai (白晓晨) 博士简介

Xiao-chen Bai (白晓晨) 博士本科和博士均毕业于清华大学,博士阶段导师为隋森芳教授;后在英国MRC实验室从事博士后研究。目前任职于美国德克萨斯西南医学中心。目前主要运用Cryo-EM等手段,从事离子通道等膜蛋白研究。目前已发表CNS正刊论文十余篇。(人物链接:https://www.utsouthwestern.edu/education/medical-school/departments/biophysics/faculty/ )
Maofu liao (廖茂富) 博士简介

Maofu liao (廖茂富) 本科毕业于清华大学,2006年于 Albert Einstein College of Medicine获得博士学位,后在加州大学洛杉矶分校从事博士后研究,合作导师是程亦凡老师(单颗粒冷冻电镜的大牛,为EM的分辨率的提升做出了巨大的贡献)。目前任职于哈佛大学医学院,主要运用cryo-EM等结构生物学手段,专注于了解蛋白质-DNA / RNA复合物和膜蛋白的结构和功能,如转运蛋白和离子通道,包括揭示蛋白质如何感知,移动和转化特定脂质分子的机制。目前的研究领域涵盖RAG12复合物,CRISPR,ERAD蛋白通道和ABC转运蛋白等。目前以第一作者或通讯作者发表文章在CNS正刊发表文章11篇。(实验室主页:https://liao.hms.harvard.edu )
Liang Feng (冯亮) 博士简介

Liang Feng本科毕业于清华大学,2006年博士毕业于普林斯顿大学,导师为施一公教授。目前任职于美国Stanford University医学院,主要运用X-ray、Cryo-EM等生物物理学方法,研究膜蛋白的功能机制,为药物开发提供靶点。目前已经以第一作者或通讯作者发表CNS正刊文章9篇。(实验室链接:https://med.stanford.edu/profiles/liang-feng?tab=publications )
Seok-Yong Lee博士简介

Seok-Yong Lee博士本科毕业于韩国延世大学,2003年博士毕业于加州大学伯克利分校。目前任职于杜克大学医学院,主要从事膜生物化学,物理生物化学,结构生物学研究。研究手段包括X-ray和Cryo-EM。获得美国NIH等多项资助。目前已在CNS主刊发表论文超过10篇。(人物链接:https://www.biochem.duke.edu/seok-yong-lee-primary )
Gabriel C. Lander博士简介

Gabriel C. Lander博士目前任职于The Scripps Research Institute。研究重点是发现维持神经元完整性的分子机制。该实验室结合多尺度高分辨率3D成像,确定维持神经元完整性所涉及的精确神经元机制。研究领域包括阿尔茨海默氏症,帕金森氏症,Lou Gehrig's和亨廷顿氏症等疾病的分子机制。主要研究手段包括EM、X-ray、NMR等。目前已发表高水平文章超过50篇,包括十余篇CNS正刊论文。(实验室主页:http://www.lander-lab.com/index.php )
参考文献
1. Baradaran, R., Wang, C., Siliciano, A. F. & Long, S. B. Cryo-EM structures of fungal and metazoan mitochondrial calcium uniporters. Nature, 1 (2018).
2. Nguyen, N. X. et al. Cryo-EM structure of a fungal mitochondrial calcium uniporter.Nature, 1 (2018).
3. Fan, C. et al. X-ray and cryo-EM structures of the mitochondrial calcium uniporter.Nature, 1 (2018).
4. Yoo, J. et al. Cryo-EM structure of a mitochondrial calcium uniporter. Science, eaar4056 (2018).
5. Kamer, K. J. & Mootha, V. K. The molecular era of the mitochondrial calcium uniporter.Nature reviews Molecular cell biology 16, 545 (2015).
6. Sancak, Y. et al. EMRE is an essential component of the mitochondrial calcium uniporter complex. Science 342, 1379-1382 (2013).
7. Kamer, K. J. & Mootha, V. K. MICU1 and MICU2 play nonredundant roles in the regulation of the mitochondrial calcium uniporter. EMBO reports, e201337946 (2014).
8 Bick, A. G., Calvo, S. E. & Mootha, V. K. Evolutionary diversity of the mitochondrial calcium uniporter. Science 336, 886-886 (2012).
9. Wu, G. et al. Single channel recording of a mitochondrial calcium uniporter.Biochemical and biophysical research communications 496, 127-132 (2018).
10. Song, J., Liu, X., Zhai, P., Huang, J. & Lu, L. A putative mitochondrial calcium uniporter in A. fumigatus contributes to mitochondrial Ca2+ homeostasis and stress responses.Fungal Genetics and Biology 94, 15-22 (2016).
11. Lee, Y. et al. Structure and function of the N‐terminal domain of the human mitochondrial calcium uniporter. EMBO reports 16, 1318-1333 (2015).
12. Oxenoid, K. et al. Architecture of the mitochondrial calcium uniporter. Nature 533, 269 (2016).
13. Wang, L. et al. Structural and mechanistic insights into MICU1 regulation of mitochondrial calcium uptake. The EMBO journal 33, 594-604 (2014).
来源:BioArt
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}