《Nature》:复旦大学开发转移性癌症准确及完全切除新技术
2018年7月24号,复旦大学张凡课题组等人在Nature communications上在线发表了题为“NIR-II nanoprobes in-vivo assembly to improve image-guided surgery for metastatic ovarian cancer”的研究论文。在这里,研究人员报告了第二个近红外窗口(NIR-II)发射下转换纳米粒(DCNPs)的DNA修饰和靶向肽的体内组装,以改善转移性卵巢癌的图像引导手术。该研究表明,在NIR-II生物成像指导下,可以完全切除≤1mm的转移。这种新技术为未来医疗应用纳米材料的设计提供了新思路。

手术切除恶性疾病是最常见和有效的治疗癌症,往往是唯一的治疗选择。在手术过程中能够显示肿瘤的全部范围,包括局部转移和显微病变,对治疗结果有着重要的意义。然而,目前外科医生主要依靠触诊和视力检查。术中对微小隐匿性肿瘤的高度敏感检测仍是常规成像方式的挑战,如X线、CT、磁共振成像(MRI)、灵敏度和信号特异性有限、获取时间长、电离辐射风险等。
相比之下,体内荧光显像已成为提高分期性肿瘤诊断、监测治疗反应和发现复发或残留疾病的一种有价值的工具。荧光显像提供了安全、无创检测的前景,其关键优点包括:在诊断和术中手术过程中,对于小肿瘤结节具有实时、高分辨率和高特异性等优点。最近,研究的重点是利用可见光和短时近红外(NIR-I,650-900 nm)波长荧光染料作为对比剂,在临床前癌症模型和人类患者中勾画肿瘤边缘。
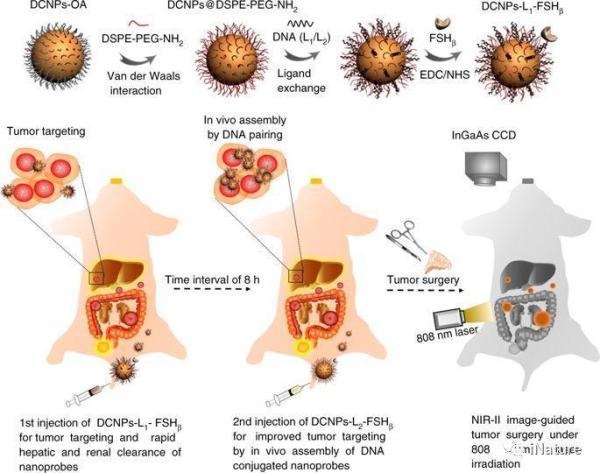
在NIR-II生物成像指导下用于卵巢转移手术的NIR-II纳米探针制造的示意图
然而,由于穿透深度有限(1-3mm)和高组织自体荧光,这些药物在手术中的反射率并不理想。第二窗口近红外荧光(NIR-Ⅱ,900~1700 nm)探针,如单壁碳纳米管(SWNTs),量子点(QDs),镧基下转换纳米粒子(DCNPs),以及有机染料在体内荧光成像方面具有广阔的应用前景。特别是DCNPs在NIR-Ⅱ荧光生物成像应用中发挥着非常重要的作用,因为DCNPs具有高度可控的粒径、非光漂白、长寿命和高效率的光学性能。
在这里,研究人员报告了第二个近红外窗口(NIR-II)发射下转换纳米粒(DCNPs)的DNA修饰和靶向肽的体内组装,以改善转移性卵巢癌的图像引导手术。DCNP的NIR-II成像质量优于临床批准的ICG,具有良好的光稳定性和深层组织穿透(8 mm)。通过纳米探针的体内组装,经历6小时的稳定肿瘤保留期可用于精确的肿瘤切除。成功地实现了良好的肿瘤与正常组织比例,促进了卵巢转移瘤的手术探查.。在NIR-II生物成像指导下,可以完全切除≤1mm的转移。这种新技术为未来医疗应用纳米材料的设计提供了新思路。
原文链接:NIR-II nanoprobes in-vivo assembly to improve image-guided surgery for metastatic ovarian cancer
来源:iNature
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}