《科学》:颜宁小组发文解析河鲀毒性为何那么强
“蒌蒿满地芦芽短,正是河豚欲上时”;河豚(又名河鲀)是饕餮们的心头好,却又因为其足以致死的毒性而令人胆战心惊,即便如此,依然抑制不住吃货们数千年来前赴后继。在河鲀毒素的化学成分为人所知之前,河鲀的毒性就已经被广泛记载,其踪迹可见《山海经》、《神农本草经》、《本草纲目》等,在埃及、日本、墨西哥等国亦有历史记载。河鲀毒素的毒性远高于砒霜、氰化钾等,若进入血液,在小鼠中达到每公斤8微克的微量即可致死,是自然界毒性最强的神经毒素之一。
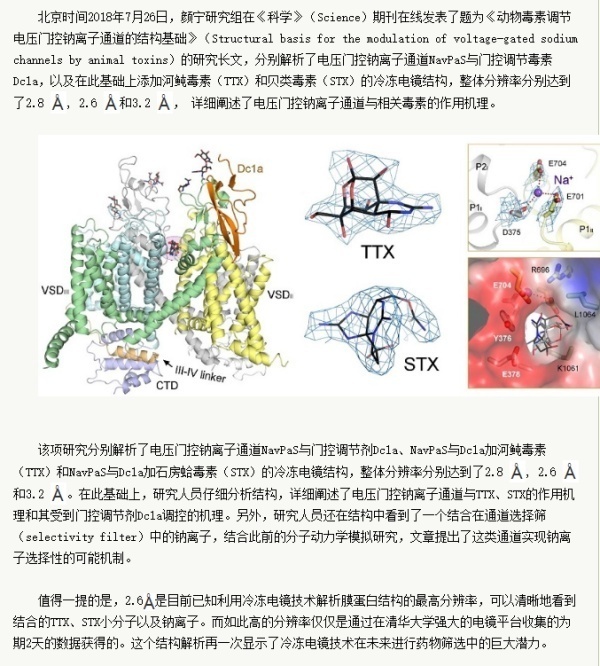
二十世纪中叶,随着对于神经系统动作电位的研究,科学家们发现河鲀毒素(tetrodotoxin, 简称TTX)的毒性就是因为高度特异性地阻断钠离子通道从而抑制了动作电位的产生,于是导致神经和肌肉麻痹。
 (河鲀。图片来源:https://curiosity.com/topics/pufferfish-are-incredibly-poisonous-so-why-do-people-eat-them-curiosity/)
(河鲀。图片来源:https://curiosity.com/topics/pufferfish-are-incredibly-poisonous-so-why-do-people-eat-them-curiosity/)
除了河鲀毒素以外,还有一类结构相似的小分子神经毒素统称为贝类毒素(saxitoxin,简称STX),是毒性最强的海洋生物毒素,其中石房蛤毒素与钠离子通道的结合能力甚至高于河鲀毒素,是误食有毒贝类导致神经麻痹中毒的主因。
因为TTX和STX对钠离子通道超高的特异性抑制,自上个世纪70年代起,它们被用来作为分子探针鉴定钠离子通道。迄今人类9种钠离子通道亚型根据与TTX的结合能力分为TTX敏感型和非敏感型。
除了TTX和STX这种小分子阻断剂,大自然中还有五花八门的多肽毒素,比如蛇、蝎、蜈蚣、蜘蛛、蟾蜍(请参考《笑傲江湖》之五毒教)的毒液中就包含着长度、成分各异的成千上万种多肽毒素。动物们利用这些毒素来进行自卫或者捕猎。相当一部分多肽直接作用于电压门控钠离子通道,导致猎物麻痹或者被咬者的剧痛。这些多肽毒素一般并非直接阻碍离子通透,而是通过作用于这些通道的电压感受域来导致钠离子通道的异常激活(打开)或者失活(关闭),因此这些毒素被称为“门控调控毒素” (gating modifier toxin, GMT)。由于这些毒素的多样性和特异选择性,更适合对症下药,有望在理解它们与特定亚型的钠离子通道相互作用的基础上开发特异的副作用小的止痛剂或者杀虫剂,因此这些毒素与钠离子通道复合物的结构一直为学术界、制药业、和农业等领域关注。但是由于钠离子通道本身结构解析的难度,此类结构信息完全空白。
该工作是颜宁研究组在清华大学成功解析了第一个真核钙离子通道结构、第一个真核钠离子通道结构、和第一个钠离子通道与调控亚基复合物结构之后针对离子通道研究的又一个重要突破,为从基础研究到转化应用打下了基础。
原清华大学生命学院、结构生物学高精尖创新中心颜宁教授是该篇研究论文的通讯作者,医学院副研究员周强以及提供Dc1a并开展相关功能分析的澳大利亚昆士兰大学的Glenn F. King 教授为共同通讯作者。清华大学医学院博士后、结构生物学高精尖创新中心卓越学者申怀宗、CLS博士生李张强、昆士兰大学博士生蒋艳和医学院博士后、结构生物学高精尖创新中心卓越学者潘孝敬是共同第一作者。原清华大学生命学院博士生吴建平博士也参与了该项研究。通讯作者和第一作者单位均为清华大学。国家蛋白质科学中心(北京)清华大学冷冻电镜平台和清华大学高性能计算平台分别为该研究的数据收集和数据处理提供了支持,特别要感谢清华大学冷冻电镜平台的雷建林博士对数据收集进行了指导并对平台的其他工作人员一并表示感谢。北京市结构生物学高精尖创新中心(清华)、生命科学联合中心(清华大学)、生物膜与膜生物工程国家重点实验室、科技部和基金委为该研究提供了经费支持。颜宁教授入职普林斯顿大学后受到Shirley Tilghman讲席教授的专项经费支持。
原文链接:Structural basis for the modulation of voltage-gated sodium channels by animal toxins


{replyUser1} 回复 {replyUser2}:{content}