12篇论文解析干细胞研究最新进展 | 研究汇总
近期,干细胞研究取得重大的进展。基于此,小编梳理了一下生物谷最新报道的干细胞方面的新闻,供大家阅读。
1、Cell:在湍流环境下,利用人诱导性多能干细胞大规模产生1000亿个血小板
Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production.
doi:10.1016/j.cell.2018.06.011
人诱导性多能干细胞(human induced pluripotent stem cell, hiPSC)提供了一种可持续地产生足够数量的血小板用于输注的方法。这种方法涉及将从人类供者体内获取的血细胞或皮肤细胞在进行表观遗传学重编程后进入胚胎干细胞样状态,然后将这些未成熟细胞转化为在身体不同部位发现的特化细胞类型。然而,在此之前利用源自hipsC的巨核细胞产生血小板的尝试未能达到适合临床制造的规模。
图片来自Misaki Ouchida/Kyoto University。
为了解决这个问题,日本京都大学iPS细胞研究与应用中心的Koji Eto及其团队注意到在培养瓶中旋转时,源自hiPSC的巨核细胞产生的血小板数量要比在培养皿中的静态条件下的多。这一观察结果提示着来自水平摇动的物理应力促进血小板产生。在这一发现之后,Eto团队在一种带有一个流动腔室和多个支柱的新型微流体系统中测试了一种基于摇摆袋的生物反应器,然而,当采用这些装置时,每个源自hipsC的巨核细胞产生少于20个的血小板。
为了研究产生血小板的理想物理条件,在一项新的研究中,Eto和他的团队接下来对小鼠骨髓---产生血液组分的组织---进行了实时成像研究。这些实验表明巨核细胞仅当暴露于湍流血流时才会产生血小板。为了验证这一想法,模拟结果表明他们之前测试过的生物反应器和微流体系统缺乏足够的湍流能量。相关研究结果于2018年7月12日在线发表在Cell期刊上,论文标题为“Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production”。
在对各种设备进行全面测试后,这些研究人员发现使用一种被称作VerMES的生物反应器可以大规模地产生高质量的血小板。这种系统由两个椭圆形的水平定向的混合叶片组成,这两个混合叶片通过在气缸中上下移动产生相对高水平的湍流。由于这种叶片运动产生的最佳湍流能量水平和剪切应力,由hipsC产生的巨核细胞产生了1000亿个血小板---足以满足临床需求。
在两种血小板减少症动物模型中开展的输注实验表明这些血小板在功能上类似于与人类捐献的血小板。具体而言,在兔子的耳朵静脉上产生切口和对小鼠的尾动脉进行穿刺后,这两种类型的血小板都相当程度地促进血液凝固和降低出血时间。
2、Nature:重磅!鉴定出导致血癌前疾病的遗传性变异和获得性突变
Insights into clonal haematopoiesis from 8,342 mosaic chromosomal alterations.
doi:10.1038/s41586-018-0321-x
克隆性造血(clonal hematopoiesis)是一种与年龄相关的白细胞病症。它与较高的某些血癌和心血管疾病风险相关联。在一项新的研究中,来自美国哈佛医学院和哈佛陈曾熙公共卫生学院等研究机构的研究人员鉴定出首批已知的遗传性基因变异中的一些基因变异能够显著增加一个人患上克隆性造血的几率。相关研究结果于2018年7月11日在线发表在Nature期刊上,论文标题为“Insights into clonal haematopoiesis from 8,342 mosaic chromosomal alterations”。论文通信作者为哈佛医学院的Po-Ru Loh、Giulio Genovese、Steven A. McCarroll和哈佛陈曾熙公共卫生学院的Alkes L. Price。
McCarrol说,“克隆性造血越来越被认为是未来疾病风险的一种重要的生物标志物,但是我们并不知道它是由什么导致的。”他说,“这些发现揭示出遗传事件---一些遗传事件是遗传性的,其他的遗传事件是获得性的---发生的特定顺序导致这些异常的血细胞产生。”
这项研究还得出了令人吃惊的结论:遗传性基因变异和获得性突变之间要比之前所理解的存在着更多的关联性。人们一般认为获得性突变会随着时间的推移随机地发生,而且是自发性出现的或者是在接触紫外线等有害物质后出现的。但是,这些研究人员发现了一些例子,在这些例子中,遗传性基因变异导致在生命后期出现特定的获得性突变,或者让携带着获得性突变的细胞比其他细胞具有生长优势。
McCarroll 说,“从概念上讲,这项研究中最有趣的事情之一就是模糊了遗传性基因变异和获得性突变之间的区别。遗传的等位基因经证实对之前被认为是一个更加随机的过程产生了强大的影响。”
Evidence for neurogenesis in the medial cortex of the leopard gecko, Eublepharis macularius
doi:10.1038/s41598-018-27880-6
最近,来自Guelph大学的研究者们发现了壁虎大脑分化产生新生细胞的干细胞。这一发现表明蜥蜴类物种在大脑受损之后同样能够再生。这一发现同样有助于开发人类大脑因年老或疾病受损后的再生。
在最近发表在《Scientific Reports》杂志上,该结果首次表明蜥蜴的大脑中存在能够促进神经元再生的干细胞。
研究者们鉴定得到了大脑皮层中负责产生新脑细胞的干细胞群体,该区域位于大脑的前叶,对于个体的社会认知以及行为具有重要的作用。它在人类中对应的区域则是被研究的十分清楚的“海马区”。
doi:10.1016/j.celrep.2018.06.091
人诱导多功能干细胞(induced pluripotent stem cells,iPSCs)可以变成人体内任何类型的细胞,被认为具有无限的治疗潜能,但是它们的基因突变情况还没有被完全表征清楚。iPSCs从体细胞重编程获得,而体细胞可能会由于接触阳光照射和紫外辐射而产生许多基因突变。尽管全世界已经有超过1000种iPSCs,过去的研究也已经探索过iPSCs中的部分基因突变,但是还没有研究完全描述iPSCs的基因突变情况。

在一项最近发表于《Cell Reports》上的研究中,来自加州大学圣地亚哥分校医学院的研究人员对他们重编程获得的18个来源于皮肤细胞的iPSCs细胞系进行了全基因组测序以找出其携带的基因突变。“iPSCs对于科学和医学而言都是一个巨大的机会,但是要真正有效地使用它们,我们必须完全明白它们的基因突变情况。”UCSD遗传医学研究所和医学院的Kelly A. Frazer教授说道。“如果我们能够检测到每个iPSCs细胞系都携带体细胞突变,那么我们就可以使用这些信息并根据不同的疾病来对这些细胞系进行排序。”
在他们的研究中,Frazer及其同事使用全基因组测序、转录组和表观遗传组学数据对18种iPSCs进行了表征。除了发现了两种过去已经发现的体细胞突变(来自亲代细胞的突变和复制导致的突变)之外,研究人员还发现了两种新的突变:紫外照射导致的亲代细胞的突变和子代细胞的突变。
研究人员发现尽管大多数突变处于表观遗传学区域,只涉及关闭的染色体且不改变基因表达,但是iPSCs重编程过程中子代细胞发生的突变出现在活性染色体并改变基因表达的概率增加。
5、ACS Cent Sci:新研究揭示沙利霉素抗癌干细胞的作用机制
The Molecular Basis for Inhibition of Stemlike Cancer Cells by Salinomycin
doi:10.1021/acscentsci.8b00257
一个来自瑞典隆德大学的研究小组开发了一种可以抑制肿瘤干细胞的新型荧光分子。通过捕获该分子进入细胞时的荧光信息使得研究人员可以使用细胞生物学手段揭示这个分子如何以及在哪里与肿瘤干细胞相互作用。
沙利霉素是一个由链球菌产生的小分子。过去的研究已经表明这个分子可以选择性对肿瘤干细胞发挥效应,但是背后的机制并不清楚。现在,隆德大学的研究人员创造了沙利霉素的荧光变异体以研究它是如何发挥作用的。
“我们已经知道它被癌细胞吸收时在哪里结束作用。通过使这个分子发出荧光,我们成功捕捉了这个分子发挥作用的过程。”在隆德大学领导了一个有机化学研究小组的Daniel Strand教授说道。
6、Nat Commun:人源多功能干细胞研究揭示控制心跳的新遗传通路
NKX2-5 regulates human cardiomyogenesis via a HEY2 dependent transcriptional network
doi:10.1038/s41467-018-03714-x
通过使用人源多功能干细胞,来自澳大利亚默多克儿童研究所的一个研究团队发现一个叫做NKX2-5的基因负责调解心跳节律及心肌细胞发育。这项研究于近日发表在《Nature Communications》上。
该研究领导作者David Elliott博士表示这个基因发生突变会导致人心脏的“电路系统”出现故障,因此NKX2-5突变的病人通常都需要植入心脏起搏器。
此前已知NKX2-5可以控制其他基因的开关。研究人员还发现NKX2-5通过直接控制另一个叫做HEY2的基因来控制心肌细胞发育。HEY2突变会引起布鲁格达综合征——一种扰乱正常心跳节律的疾病。
7、Nat Commun:科学家成功将皮肤细胞重编程为多潜能干细胞
Human pluripotent reprogramming with CRISPR activators.
doi:10.1038/s41467-018-05067-x
我们的体内含有多种类型的细胞,每一种细胞都扮演着不同的类型的角色,2012年诺贝尔获奖者—日本科学家山中伸弥通过研究将成体皮肤细胞成功转化成了诱导多能干细胞(ipsC),这一过程称之为重编程作用。

图片来源: Otonkoski Lab/University of Helsinki。
截止到目前为止,重编程过程仅可能引入关键的基因促进细胞类型的转化,这种基因称之为“山中因子”(Yamanaka factors),其能被被人工转入到正常情况下并不具有活性的皮肤细胞中;近日,来自芬兰赫尔辛基大学等机构的科学家们通过激活细胞自身的基因,成功将皮肤细胞转化成了多能干细胞,相关研究刊登于国际杂志Nature Communications上,文章中,研究人员利用基因编辑工具CRISPRa直接对细胞中相关的基因进行了激活,他们利用了一种“钝化”版本的Cas9剪刀,其并不会对DNA进行切割,而是能在不对基因组进行突变的基础上来激活基因的表达。
研究者Otonkoski教授表示,CRISPR/Cas9基因编辑系统能用来激活基因的表达,其在细胞重编程上能表现出巨大的潜力,因为其在同一时间里能对多个基因进行靶向作用,相比对转基因进行过表达作用,基于激活内源性基因的重编程过程从理论上来讲能够以一种生理学的方式来控制细胞的命运,同时还能产生较多正常的细胞;文章中,研究人员对CRISPR激活系统进行了工程化修饰,使其能够对细胞进行强大的重编程作用以产生诱导多能干细胞。
8、Cancer Res:科学家揭示结肠癌新起源 小肠上皮细胞去分化是重要成因
SMAD4 suppresses WNT-driven de-differentiation and oncogenesis in the differentiated gut epithelium
doi:10.1158/0008-5472.CAN-18-0043
一般认为结肠癌的细胞起源是残留的成体干细胞,这些细胞具有永生化的特点,并且逃脱了小肠上皮进行连续细胞更新的过程。但是,最近一些研究发现在某些特定条件下,分化的细胞也可以获得干细胞样特征,并形成肿瘤。确定这类肿瘤的细胞起源将有助于癌症预防以及癌症治疗,不同起源的癌症通常对不同的治疗方法产生应答。最近来自美国新泽西州立大学的研究人员对分化的小肠上皮细胞如何形成肿瘤进行了深入研究,相关研究结果发表在国际学术期刊Cancer Research上。
在这项研究中,研究人员发现了肿瘤起源于分化的小肠上皮的一种新情况。他们观察到在小肠上皮细胞中,促分化转录因子SMAD4的失活能够在短期时间内得到很好的耐受,但是在几个月后,会形成腺瘤并伴随着Wnt信号途径的激活。SMAD4失活和WNT信号途径的激活同时发生会导致已分化组织发生去分化并快速形成腺瘤。
转录分析结果表明,在SMAD失活和WNT途径激活同时发生的情况下,这些去分化的细胞获得了干细胞特征,表达分化小肠标志物的细胞进入细胞周期重新表达干细胞基因。
这些结果表明,当癌基因WNT信号途径存在的时候,SMAD4能够维持分化的小肠细胞特征,因此阻止了分化的小肠上皮细胞发生去分化和肿瘤形成,针对这一现象未来可对结肠癌成因进行进一步分析,实现精准靶向治疗。
Notch ligand Dll1 mediates cross-talk between mammary stem cells and the macrophageal niche.
doi:10.1126/science.aan4153;
Macrophages stimulate mammary stem cells.
doi:10.1126/science.aau1394
干细胞微环境(stem cell niche, 也译作干细胞壁龛)在调节关键性的干细胞性质(包括自我更新、分化和细胞命运变化)中起着至关重要的作用。虽然几种器官中的干细胞微环境已得到很好描述,但是乳腺干细胞(mammary gland stem cell, MaSC)微环境的细胞特征和分子特征在很大程度上仍未得到充分研究。乳腺基质细胞群体---包括成纤维细胞、巨噬细胞和其他的免疫细胞---对乳腺发育是比较重要的,并且与MaSC微环境的功能有关。然而,导致乳腺基质细胞依赖性的MaSC活性调节的信号机制仍然是未知的。深入认识MaSC与它们的微环境细胞之间的交谈对理解正常的组织稳态和乳腺癌等疾病状况是非常重要的。
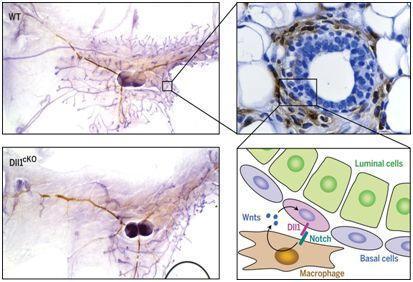
图片来自Science, doi:10.1126/science.aan4153。
在一项新的研究中,来自美国和荷兰的研究人员着重关注一种被称作Dll1的Notch配体,这是因为这种Notch配体在富含MaSC的乳腺上皮细胞(mammary epithelial cell, MEC)群体中高度表达。在乳腺上皮细胞中进行Dll1条件性敲除会导致乳腺发育期间的分支形态发生(branching morphogenesis)显著延迟,而且会导致怀孕和哺乳期间的肺泡形成不足,这提示着Dll1介导的通路在乳腺发育中起着关键性的作用。相关研究结果发表在2018年6月29日的Science期刊上,论文标题为“Notch ligand Dll1 mediates cross-talk between mammary stem cells and the macrophageal niche”。
这些研究人员发现不论是处女小鼠还是怀孕小鼠,Dll1条件性敲除小鼠在不同的乳腺发育阶段具有下降的MaSC数量。再者,他们利用Dll1报告小鼠发现Dll1表达富集在MaSC中,而且Dll1阳性MaSC要比Dll1阴性MaSC具有更大的再生潜力。对Dll1-Cre-ERT2;dTomato报告小鼠进行谱系追踪揭示出Dll1阳性MaSC能够产生乳腺基底细胞和管腔细胞。Dll1条件性敲除小鼠表现出显著下降的乳腺巨噬细胞数量。乳腺巨噬细胞具有的分子特征包括Wnt和Notch信号通路中的组分富集,这就使得它们不同于其他组织中的巨噬细胞。Dll1结合乳腺巨噬细胞表面上的Notch2和Notch3,从而激活Notch信号,这是维持MaSC微环境中的巨噬细胞数量和它们的促进MaSC的活性所必需的。利用一种MaSC-巨噬细胞共培养系统,他们也证实MaSC表达的Dll1诱导巨噬细胞中的Wnt配体(比如Wnt3、Wnt10和Wnt16)表达,而且这些Wnt配体反馈回到MaSC中,从而促进MaSC的干细胞活性。涉及遗传和药物剔除巨噬细胞以及巨噬细胞特异性的Notch信号转导缺乏的体内实验进一步证实了乳腺巨噬细胞在维持MaSC活性中的关键作用。
10、Cell Rep:科学家鉴别出能有效维持造血干细胞功能的关键蛋白分子
Variable SATB1 Levels Regulate Hematopoietic Stem Cell Heterogeneity with Distinct Lineage Fate.
doi:10.1016/j.celrep.2018.05.042
近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自日本大阪大学的科学家们通过研究发现了一种名为SATB1的特殊分子在造血干细胞分化成为淋巴细胞谱系上扮演着关键角色,SATB1,即富含AT的序列结合蛋白1(AT-rich Sequence Binding Protein 1),其是细胞核广泛的染色质组织者。
文章中,研究人员通过对遗传工程化细胞和小鼠胚胎进行研究得到了上述结果,然而研究人员并未阐明成年人机体中这些生物学过程发生的分子机制,此外,研究者也并不清楚淋巴细胞谱系开始发生分化的机制和方式。研究者指出,SATB1的表达主要涉及造血干细胞自我更新能力的差异和其分化为淋巴细胞谱系的差异。
研究人员通过遗传工程操作制造出了造血细胞中SATB1缺失的小鼠以及报道小鼠,所谓报道小鼠,就是在内源性SATB1启动子的控制下能够表达红色荧光蛋白的小鼠,随后研究人员对小鼠进行研究证实了,SATB1能够帮助有效维持成年小鼠机体中造血干细胞的功能。研究者指出,SATB1的高表达和低表达在造血干细胞中均存在,而且造血干细胞自我更新期间SATB1的表达量也能够发生改变,此外,SATB1的高水平表达也能够促进造血干细胞拥有较强的淋巴细胞分化能力。
11、Cell Metabol:通过靶向作用癌症干细胞的代谢来成功治疗癌症
Targeting Breast Cancer Stem Cell State Equilibrium through Modulation of Redox Signaling
doi:10.1016/j.cmet.2018.06.006
日前,一项刊登在国际杂志Cell Metabolism上的研究报告中,来自密歇根大学的研究人员通过研究发现了一种至关重要的线索,或能帮助解释癌细胞为何会对疗法产生一定的耐受性。2003年,研究者Max S. Wicha及其同事通过研究发现,肿瘤中的一小部分细胞,即癌症干细胞能够有效促进癌症生长和扩散,而杀灭这些癌症干细胞或许就能够彻底消灭癌症。

图片来源:Dr. Triche National Cancer Institute。
研究者表示,当我们利用靶向疗法时,这些疗法通常仅会在一个特定的时间段内发挥作用,随后癌症就会对疗法产生一定耐受性,很多癌细胞耐受性都源于癌症干细胞的作用,其能够通过改变形式来躲避靶向疗法的杀灭作用,因此研究人员或许就需要开发出多种干细胞疗法来攻击多种形式的癌症干细胞。
研究者指出,细胞代谢或许就能够控制这些改变,这同时也提出了一种能有效攻击癌症干细胞的可能性策略;细胞能通过线粒体来获得能量,而这依赖于细胞中氧气和葡萄糖的水平,而癌症干细胞则能够操控所有的能量供给方式,在休眠状态下,其能够利用葡萄糖,而在增殖状态下,其则主要依赖于氧气水平。
因此研究人员就能以上述两种方式来攻击癌症干细胞的代谢过程,文章中,研究者利用了一种用来治疗关节炎的药物进行研究,这种药物能阻断细胞中线粒体的功能,同时其还能控制细胞的葡萄糖水平从而间接阻断癌细胞利用葡萄糖的路径,当研究人员对乳腺癌小鼠进行检测时他们发现,这种药物能有效阻断癌症干细胞的正常功能。
12、Stem Cell Rep:科学家成功鉴别出精原干细胞自我更新因子的新功能 有望开发男性不育疗法
FGF2 Has Distinct Molecular Functions from GDNF in the Mouse Germline Niche.
doi:10.1016/j.stemcr.2018.03.016
近日,一项刊登在国际杂志Stem Cell Reports上的研究报告中,来自日本信州大学(Shinshu University)的科学家们通过研究发现了成纤维细胞生长因子2(FGF2)的新功能,FGF2是精原干细胞(spermatogonial stem cell)的一种自我更新因子,而精原干细胞是精子产生的起源。尽管此前研究人员通过研究发现,FGF2和胶质细胞衍生的神经营养因子(GDNF)对于精原干细胞的自我更新和生存是比不可少的,但本文研究中研究者却发现,GDNF在小鼠睾丸中或许扮演着不同的特性,相关研究或能帮助研究人员阐明精原干细胞的调节机制,从而开发出治疗男性不育的新型疗法。
研究者Seiji Takashima教授表示,这项研究中,我们利用生物降解的明胶微球系统(biodegradable gelatin microsphere system)成功鉴别出了FGF2在小鼠睾丸中扮演的新角色,这种微球系统能在体内维持数天自我更新因子的扩散。
精原干细胞的重复自我更新及分化是精子不断连续产生的关键,我们都知道,精原干细胞的自我更新能受到GDNF的促进作用,而且维甲酸(RA)还能够诱导精原干细胞的分化,促进精子产生;2015年研究人员通过研究发现,FGF2在体外同样扮演着精原干细胞自我更新因子的角色,而本文研究中,研究人员则发现,FGF2能在体内扮演精原干细胞的分化促进因子。
研究者表示,相比GDNF所刺激的精原干细胞而言,FGF2刺激的精原干细胞能够频繁表达RA的受体,这就表明,FGF2能够扩大精原干细胞的分化易感群,同时这种分子还能营造睾丸微环境从而附近RA的活性,这种微环境对于精原干细胞的产生非常重要。相关研究结果表明,2015年研究人员所发现的能作为精原干细胞的自我更新因子—FGF2或能在体内促进精原干细胞的分化,在睾丸发育和再生过程中,GDNF/FGF2的比率会表现出动态的改变,而且GDNF和FGF2之间的功能平衡或许在精子产生过程中扮演着关键的调节作用。


{replyUser1} 回复 {replyUser2}:{content}