《Nature》重磅:首次发现影响CRISPR体内修复效率的关键因素
尽管人们对CRISPR-Cas9基因编辑抱有很高的期望并且已经进行了大量的投入,但科学家仍然不清楚它如何在人体中发挥作用。
在一项最新的研究中,加利福尼亚大学伯克利分校的科学家发现人们调控CRISPR修复效率的关键是Fanconi贫血途径。该研究于7月27日在线发表在nature genetics上。

视频链接:CRISPR-Cas9基因编辑与Fanconi贫血途径有关
科学家解释了CRISPR-Cas9基因编辑后细胞如何修复DNA以及这项新的研究结果如何影响基因组编辑的发展。(视频来源:berkeley)
本文通讯作者Jacob Corn教授表示:“基因编辑是超级强大的,有很多希望,但到目前为止,也存在大量的试验和错误。它在人体细胞中起作用的方式一直是一个有很多假设的黑匣子。而现在,我们终于开始了解正在发生的事情。”
这一发现深入探讨了为什么CRISPR-Cas9基因编辑为什么没有在所有细胞中都取得同样的成功。它可以帮助研究人员提高将新DNA插入基因组的效率,例如用正确的DNA序列替换有害突变,并且调整CRISPR-Cas9编辑以获得所需的结果。
CRISPR依赖于DNA修复
CRISPR-Cas9具有革命性,因为它能够精确地利用基因组中数十亿的特定DNA序列并切割双链DNA分子。但在此之后,由细胞来修复损伤。
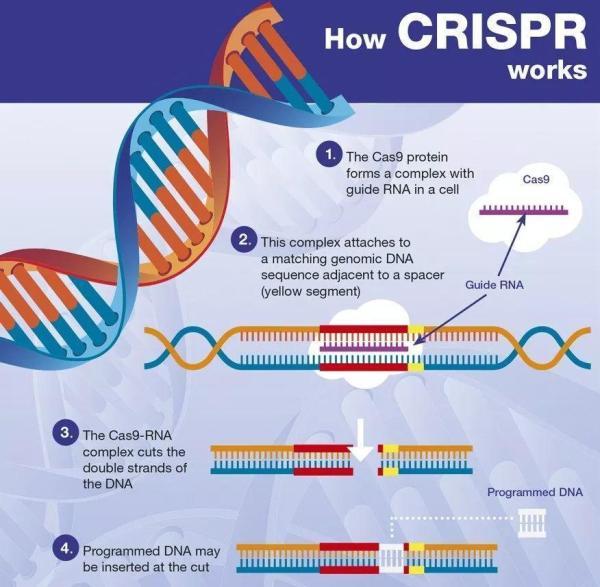
CRISPR原理(图片来源:brainask)
双链DNA断裂(DSB)的修复可以通过两种方式进行:
-非同源末端连接(NHEJ),不需要DNA模板,似乎是CRISPR切割后最常见的结果;
-同源定向修复(HDR),在某些类型的细胞中比其他细胞更频繁地发生,并且需要存在可用于修补DSB的DNA片段以代替错误序列。
然而,这两个过程都有点神秘,没有人知道为什么有些细胞很容易利用DNA进行修复,而其他细胞很少这样。
另外,同源定向修复(HDR)还分为同源重组修复和单链模板修复(SSTR),它们的DNA供体分别是双链DNA(dsDNA)(线性和质粒)以及单链寡脱氧核糖核苷酸(ssODNs)。
在大多数细胞类型中,从dsDNA供体修复效率相对较低,并且假设利用的是一种与减数分裂同源重组相似的修复机制。相比之下,SSTR在人体细胞中高效(> 20%的等位基因)并且在后生动物中广泛保守。
建立筛选平台:检测CRISPR介导的SSTR的相关通路
在筛选人类癌细胞系时,研究人员发现在给定基因座处以SSTR为主的基因组编辑可以从完全无效(0%SSTR)到非常有效(30%SSTR),具体取决于细胞背景。这意味着在不同背景下基因或转录的差异能上调或下调基因编辑。因此,研究人员决定检测与CRISPR-Cas9介导SSTR的相关通路。
首先,他们开发了一个能够在人体细胞中检测多种编辑结果的耦合抑制-编辑筛选平台,结合数千种单个CRISPR抑制(CRISPRi)Cas9编辑基因的单拷贝,基因组整合蓝色荧光蛋白(BFP)报告基因。筛选池中的各个细胞稳定表达dCas9-KRAB CRISPRi构建体以及一个靶向转录起始位点基因的gRNA。然后将该池与预成型物进行核转染,包括靶向BFP报告基因的Cas9-gRNA RNP复合物和一个编码3-bp密码子将BFP转换成绿色荧光蛋白(GFP)报告基因的ssODN。
然后,编辑后的细胞通过荧光激活细胞分选(FACS)进行分离,分为未编辑的(BFP + / GFP-),插入缺失(BFP- / GFP-)和SSTR编辑(BFP-/ GFP +)。接下来,通过Illumina测序来比较哪些靶基因促进(编辑的细胞中下调的gRNA)或限制(编辑的细胞中富集的gRNA)具体的基因组编辑。
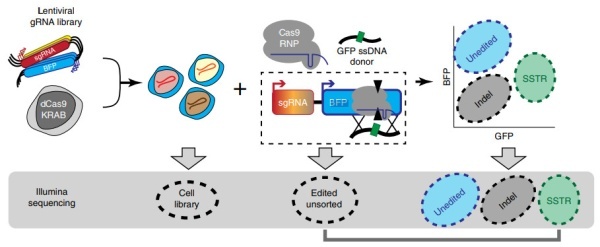
编辑细胞的筛选机制
Fanconi途径在SSTR修复中起关键作用
为了确定Cas9介导的SSTR所需的因素,研究人员使用FACS分离GFP +细胞,并测量其相对于未分类的编辑池的gRNA丰度。
结果中,最引人注目的是,相对于未分类的编辑细胞,Fanconi途径(FA)中70%(28/40)的基因在GFP+细胞中被强烈地耗尽。因为Fanconi途径(FA)先前被认为是一个对Cas9介导的基因组编辑不重要的修复系统,并且通常被认为是链间交联而不是核酸酶诱导的断裂的反应。而此次研究中的生物基因集丰度分析也证实:一般的DNA修复和特别是FA途径是SSTR的一个定义特征。
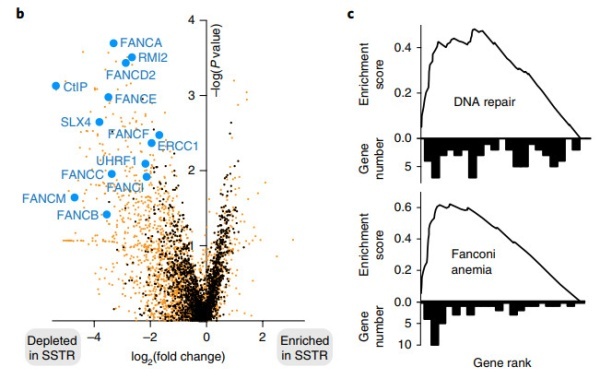
FA途径与Cas9介导的基因组编辑强烈相关
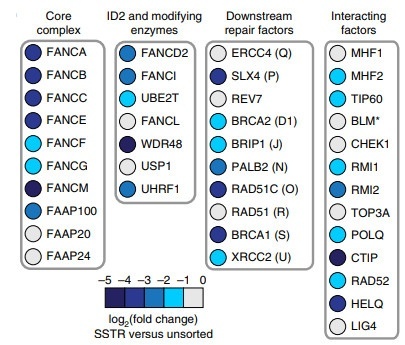
FA修复途径的多个组分在SSTR中起作用
丨Fanconi途径
该途径涉及21种不同的蛋白质,因为如果编码这些蛋白质的任何基因受损,就会产生Fanconi贫血症,这是一种罕见但严重的遗传性疾病,患者骨髓不能产生足够的血细胞。该疾病伴随着出生缺陷和癌症高风险,患者在童年时发生白血病的几率为10%,并且很少有患者活到30岁以上。
该途径已被人们所知并研究了数十年,但人们普遍认为它可以修复一种特殊的DNA损伤:DNA链间交联,即其中一条DNA链上的核苷酸与相邻链上的核苷酸紧密结合,干扰DNA复制并经常杀死细胞。
FA途径介导NHEJ和SSTR之间的平衡
下一步,研究人员对导致镰状细胞病的血红蛋白亚基β(HBB)基因座(Glu6Val)进行了编辑,他们发现全部七个FA因子都是SSTR编辑所必需的。值得注意的是,FA的基因敲低降低了SSTR水平,同时增加NHEJ的水平,最终总编辑水平保持相对稳定。
而在没有ssODN的情况下编辑HBB基因座时,FA的基因敲低没有显著增加NHEJ频率,并且在编辑BEP基因座时得到了类似的结果。这说明,FA途径不影响NHEJ。
另外,在人成纤维细胞的基因编辑中,通过siRNA敲低FA修复途径中的FANCA或FANCE,SSTR减少了约五倍。
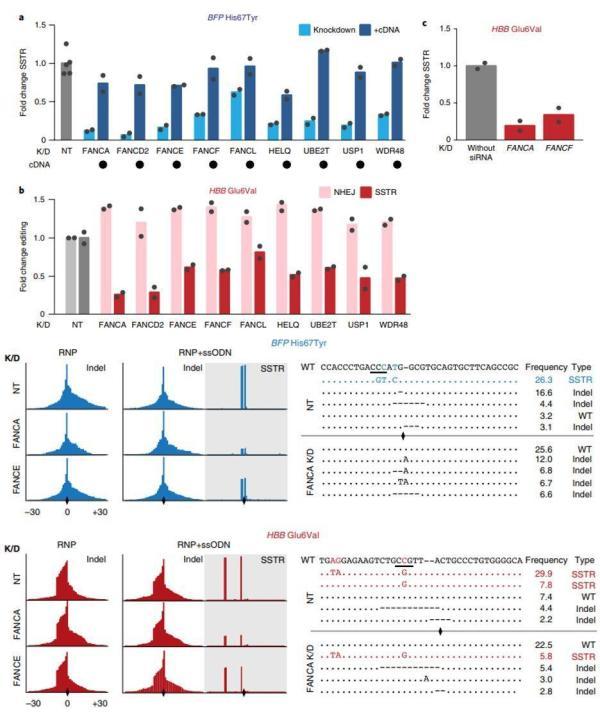
FA途径与SSTR显著相关
在没有ssODN情况下,FA修复途径既没有影响整体的频率也没有影响插入缺失的方式。相反,当使用ssODN进行编辑时,SSTR在FA修复途径受到干扰时显著降低。
总之,FA途径的作用仅限于SSTR修复和NHEJ和SSTR之间的平衡,在易出错的末端连接途径(NHEJ)中没有直接作用。
丨SSTR依赖于FA基因下游的特定亚复合物
FA基因一般通过依赖特殊的亚复合物来保持基因组的稳定性,其中一部分是解旋酶,包括布鲁姆综合征蛋白(BLM)和3'-5'DNA POLQ样解旋酶(HELQ)来对抗异常的染色体结构和复制应激。
因此,研究人员通过对BLM和HELQ的敲低发现BLM对SSTR没有影响,但HELQ能显著影响SSTR。HELQ还能与BCDX2重组亚复合物(RAD51B,RAD51C,RAD51D和XRCC2)相互作用,但与CX3子复合体无关(由RAD51C和XRCC3组成)。这些复合物都能促进ssODN和基因组DNA之间的重组。
于是,研究者还研究了这些复合物是否会影响SSTR,他们发现RAD51C是SSTR所必需的,但RAD51B和XRCC2不是。这表明BCDX2复合物在SSTR中不起作用。相反,RAD51C和XRCC3都是SSTR所需要,表示CX3子复合体在SSTR中起作用。
未来的工作应找出FA途径如何与聚合酶和介导重组的基因相互作用,这或许将为SSTR的机制及其与维持基因组稳定性的其他途径的相互作用提供有价值的见解。
FA途径的核心组分
定位于Cas9介导的双链断裂位点
FANCD2是FA途径的核心参与者,在链间交联和紫外线损伤时均可检测到。因此,研究者用染色质免疫沉淀测序(ChIP-seq)确定了FANCD2响应Cas9编辑的全基因组定位。
令人惊喜的是,对几种细胞的进行基因编辑,包括K562(慢性骨髓性白血病细胞)、HEK293(人胚肾上皮细胞),发现FANCD2在编辑的目标位点(on target)上显示大量富集,极少在脱靶位点(off target)出现富集,并且没有在未报道过的脱靶位点上出现富集。
基于此,研究人员提出了一种模型,即FANCD2能定位于Cas9编辑后的双链断裂位点。这可能是通过残留物Lys561的单泛素化使下游活化,控制下游的修复结果。这也表明FANCD2在CRISPR-Cas9基因编辑的调节中起重要作用。
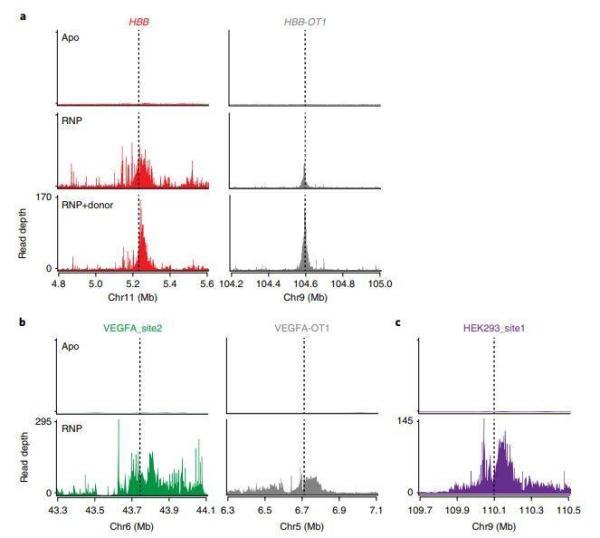
FANCD2定位于双链断裂位点
(Apo:Cas9 alone RNP:Cas9+single guide RNA RNP+donor:Cas9+RNP+ssODN)
FA途径充当交通信号
其活性水平或影响CRISPR-Cas9效率
综上,整个FA途径影响末端连接和同源定向修复之间的平衡,充当交通信号。末端连接是DNA双链断裂后的默认修复机制,但FA途径与其竞争,并且更高的活性将导致更多的同源定向修复(HDR)和更少的末端连接。因此,FA途径的活性水平可能会影响CRISPR在特定细胞中插入DNA的效率。
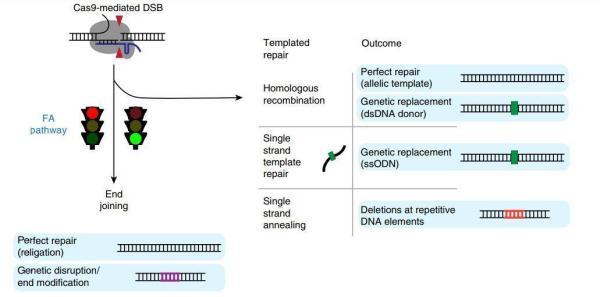
FA途径充当交通信号
其次,该途径中的21种蛋白质之一FANCD2始终位于CRISPR-Cas9产生的双链断裂位点,意味着或许可以通过调节FANCD2的表达以提高细胞通过同源定向修复(HDR)插入DNA的频率。另外,通过绘制基因组中FANCD2的位置即可找到基因编辑目标和目标外的切割位置。
然而,FA途径在修复CRISPR断裂中的重要性使人怀疑一些使用HDR修复的CRISPR治疗方法。因为没有活跃的FA途径,在Cas9切割后,细胞可能无法通过HDR修复来将正常基因替换其突变基因。
而更具前瞻性的是,FA途径相关因子的表达水平可作为患者细胞“可编辑性”的生物标志物,增强FA途径的活性可能在难以编辑细胞的治疗中特别有价值。
论文原文:
CRISPR–Cas9 genome editing in human cells occurs via the Fanconi anemia pathway
参考资料:
DNA repair after CRISPR cutting not at all what people thought
DNA repair after CRISPR cutting not at all what people thought


{replyUser1} 回复 {replyUser2}:{content}