《自然》:变数陡增!科研机构的癌细胞系竟在偷偷“进化”
有句玩笑话说,想攻克癌症的研究者,哪个没杀过天文数字级别的癌细胞。这些以别样方式“活”在实验室里的癌细胞们,作为科研的第一手材料,为癌症生物学和转化医学的发展做出了巨大的贡献[1]。
科学家们早就认识到,癌细胞系是不能够完全模拟人体内的肿瘤的,不过它仍然具有一定程度的代表性和稳定性,足以提供对癌症发展和药物反应的准确反馈。事实上,走向临床的各种药物、疗法,第一次闪光都是踩在癌细胞系的尸体上。
可是实验室内的癌细胞系并不如科学家们所想的那样稳定,它们也在时刻“进化”之中,甚至对药物的反应会产生大幅度的变化!
本周的《自然》杂志刊登了来自Broad研究所的最新科研成果。研究者们对比了来自两个数据库的106个癌细胞系的外显子测序数据,发现同一细胞系之间竟然五分之一的基因序列差异!进一步分析了单一乳腺癌细胞系的27个细胞株,研究者发现同样存在高水平的遗传多样性,测试的321种抗癌化合物中,有75%虽然能对特定细胞株产生抗癌活性,但是在其他细胞株中完全没用![2] Genetic and transcriptional evolution alters cancer cell line drug response
 这或许也可以解释为什么有些实验,明明是用了同一癌细胞系,却会得出不同的结果。科学家们必须得小心了,这意味着培养皿里的细胞们,说不定根本不能代表正在研究的癌种!
这或许也可以解释为什么有些实验,明明是用了同一癌细胞系,却会得出不同的结果。科学家们必须得小心了,这意味着培养皿里的细胞们,说不定根本不能代表正在研究的癌种!

通讯作者之一,Todd Golub,大牛

通讯作者之二,Raemeen Beroukhim
从理论上来说,实验室里的细胞传代没有环境施加的选择压力,遗传上相对来说是稳定的,那么按照这个道理来说,利用癌细胞系进行的实验结果是可以重复的。但是实际上却截然相反,特别是倍受关注的药物研究,对药物的敏感性和耐药性经常会得出不一致的结果[3]。
这不由得让人猜想,难道这些癌细胞根本不如我们认为的那么稳定?
研究者们从Broad研究所的癌症细胞系百科全书(CCLE)和Sanger研究所的癌症药物敏感性基因组学(GDSC)数据库中,提取了106个细胞系的外显子测序数据。讲道理,都是同一个细胞系,具有同样的遗传背景,提取到的数据不说一模一样吧,也应该差不了多少。
结果让研究者大失所望,两组数据的基因突变一致性比预想的低很多,约19%的错义突变仅出现在两组其一,在拷贝数变化上这个数字则达到了26%。

研究者对单个细胞系进行了研究。他们选中了癌症研究中常用的雌激素受体阳性乳腺癌细胞系MCF7,涉及27个不同的细胞株,其中19个未经过任何药物影响或者基因工程改造,7个细胞株含有报告基因,还有1个已经被移植入小鼠体内,并接受了抗雌激素治疗。
在这27个细胞株中,研究者发现数百种基因的拷贝数发生了变化,283种基因拷贝数增加,405种减少;其中,只有13%增加拷贝的基因和21%减少拷贝的基因是所有细胞株都存在的;而只有一个细胞株具有,独一份儿的拷贝数变异基因则分别是7%和13%。
这些受影响的基因包括PTEN、TP53、EGFR、PIK3CA、MAP2K4等乳腺癌常见的突变基因,就拿PTEN来说吧,有17个细胞株都出现了PTEN缺失突变。还有表达雌激素受体的基因ESR1,12个细胞株拷贝增加,6个细胞株拷贝丢失——这与雌激素受体表达水平是息息相关的,而MCF7可是一个以雌激素受体阳性为特征的癌细胞系!
其他的突变类型数据也是类似的,95个单点突变中,只有35%存在于所有细胞株中,29%只存在于某个细胞株中。
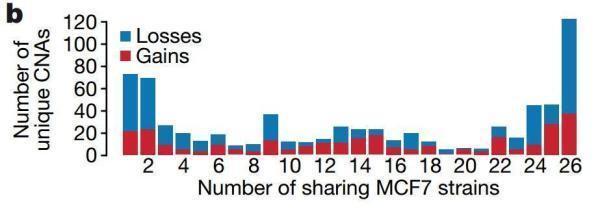
各个细胞株具有的拷贝数变异
与突变情况一致,27个细胞株之间基因表达水平也有很大的差距。将细胞株两两对比,最惨的情况下有1574个基因表达水平差异达到了2倍以上(中位654个)。
研究者还在常见的肺癌细胞系A549的23个细胞株,以及其他11个癌细胞系中进行了验证,从单点突变到结构变异,都存在高水平的差异。

各个细胞株中的单点突变
基因层面发生了如此大的变化,细胞功能也受到了影响,不同细胞株之间传代时间、细胞的大小和形状都十分不同,对药物的反应也相距甚远。
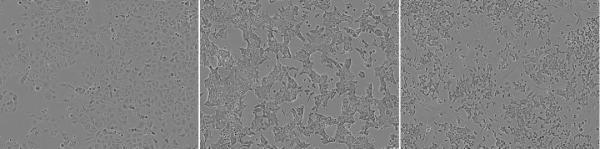
同个细胞系的不同细胞株形态竟然能差这么多
研究者们在27个MCF7细胞株中测试了321种具有抗癌活性的化合物,有55种化合物在至少一个细胞株中表现出强抗癌活性,对癌细胞生长的抑制>50%,然而其中的48种(87%)却在至少一个细胞株中基本没用!
把标准再拉得严格一点,同时在至少两个细胞株中都有强抗癌活性的化合物有42种,但是33种(79%)在两个以上的细胞株中不起效果……
另外要说的是,这种变化可不是仅仅癌细胞有,正常的细胞系也是存在的,而且突变水平并不比癌细胞差。
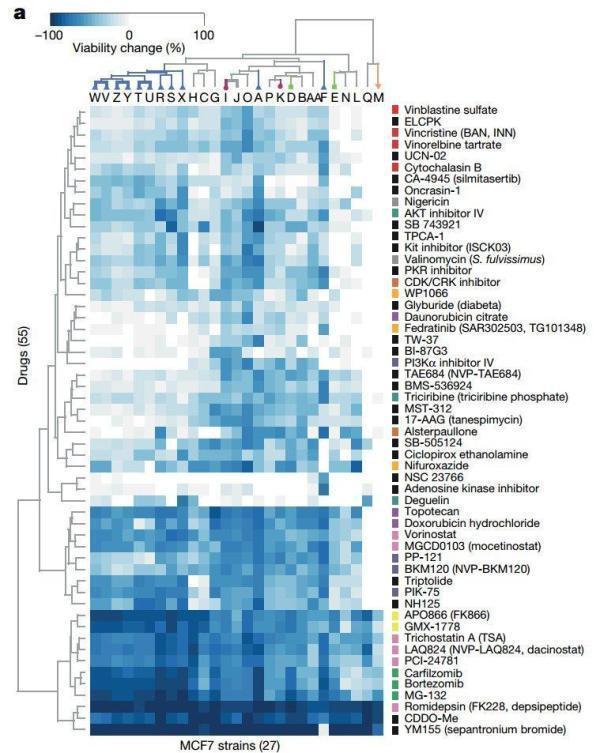
细胞株对药物的反应
那么这些突变是打哪儿来的呢?
研究者在不同条件下培养细胞系,发现仅仅是不同的培养基条件就足以影响细胞的基因形态。与物种的进化一样,培养环境也能够对细胞株进行“自然选择”,使某些细胞更有生存优势,走在“进化”的前列;此外,就算是从细胞系中分离单个癌细胞进行培养,子代细胞也能够获得新的突变。
本研究与该团队的另一项研究可以说是一脉相承的。去年,他们发表在《自然遗传学》的论文显示[4],随着时间推移,移植到小鼠体内的人类癌细胞逐渐失去了患者的疾病特征,并且获得了一些新的表型,与对药物的敏感性变化有关。
这对科学家们来说并不是个好消息,但也并不是个那么坏的消息。癌细胞系依旧是实验室不可或缺的研究工具,只是研究者们可能需要更加密切地关注高度变异导致的功能变化。
而挑战换个角度看就会变成机遇。利用癌细胞的自我“进化”,科学家们可以在同样遗传背景的两个细胞株上测试同种化合物,并利用细胞特征来解析作用机制,以及研究各种进化压力与癌症发展的关系。
通讯作者Todd Golub表示,“这并不意味着癌细胞系和基于培养基的生物模型都不够好,反之,我们应当了解模型的特点和局限性,在了解未知的基础上继续探索,而绝不是弃之不用。”[5]
为此,研究者们也开发了一款在线工具Cell STRAINER,可以提供细胞株与CCLE中细胞系样本遗传数据的对比。
这不禁让我想到了以基因数据为基础的“精准医疗”,看来是时候搞搞“精准科研”了。
参考资料:
[1]Sharma, S. V., Haber, D. A. & Settleman, J. Cell line-based platforms to evaluate the therapeutic efcacy of candidate anticancer agents. Nat. Rev. Cancer 10,241–253 (2010).
[2]Genetic and transcriptional evolution alters cancer cell line drug response
[3]Barretina, J. et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature 483, 603–607 (2012).
[4]Barretina, J. et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature 483, 603–607 (2012).
[5]Cancer cell lines evolve in ways that affect how they respond to drugs


{replyUser1} 回复 {replyUser2}:{content}