遗传学大牛最新成果!利用CRISPR实时记录每个细胞的历史
著名遗传学George Church是哈佛医学院的遗传学教授、Wyss研究所的核心成员。他开发了首个直接基因组测序和DNA多重化方法,为1994年破译首个细菌基因组合2003年的二代测序技术奠定基础。在CRISPR/Cas出现在大众视野之前,Church就已经撰文详细介绍了Cas9 靶定方法、改造进展,并就未来临床上的潜在应用提出建议。
Church表示:“我是一个技术狂,年轻时,我会采取不限于生物学的各种技术手段,也使得我看到了许多罕见的食物。我曾预测到将来可能会在人体细胞中编辑基因,于是一旦将实验室组建起来,就立马投入这项工作,并且发现在人体细胞中编辑DNA很有效。”
在最新的一项研究中,Church研究组发表了一项新技术,可以利用不断发展的遗传条形码来记录发育中小鼠细胞分裂的过程,追溯小鼠体内每个细胞的谱系单细胞来源。 这种方法能帮助科学家确定不同细胞出现的位置和时间,以及不同细胞类型之间的密切关系,从而前所未有地深入探索从受精卵到成年人的这个奇妙生命旅程。
这一研究成果公布在Science杂志上。
生命奇妙旅程
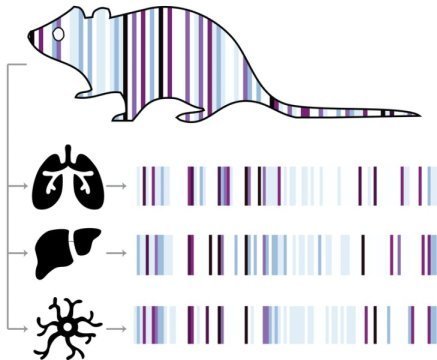
随着生物机体的发育,每个细胞都从其亲本细胞中继承了hgRNA序列突变,并获得其自身独特的突变,然后将其传递给后代细胞。通过比较身体不同部位(肺,肝和神经元)的细胞之间的突变模式,科学家可以确定这些部位何时发展,以及它们彼此之间的密切关系。
人体开始于单个细胞,细胞重复分裂形成两个,然后是四个,然后是八个,一直到构成新生儿的约260亿个细胞。追踪这些260亿个细胞是如何以及何时从一个受精卵中产生的,是发育生物学的一大挑战,这个领域到目前为止只能捕获和分析部分快照图像。
CRISPR条形码
“当前的谱系跟踪方法只能及时显示快照图像,要想看清楚每一步,必须在物理上停止发育过程,就像看电影的各个帧一样”,Church说。
遗传条形码是使用特殊类型的DNA序列创建的,该序列编码一种称为归巢指导RNA(hgRNA)的修饰RNA分子,设计hgRNA分子使得当存在Cas9(CRISPR-Cas9)时,hgRNA将引导Cas9至其基因组中的自身hgRNA序列,然后Cas9进行切割。细胞修复切割时,它可以在hgRNA序列中引入基因突变,其随着时间累积以产生独特的条形码。
“这种条形码记录方法使我们能够重建每个成熟细胞发育的完整历史,就像实时向后播放完整的动态图像一样。”
这种方法令细胞谱系追踪成为了可能,通过不断发展的遗传条形码,记录发育中小鼠的细胞分裂过程,追踪实现每一种谱系。小鼠体内的细胞可以追溯到它的单细胞来源。
研究人员通过创建一种“原始小鼠(founder mouse)”在小鼠体内构建hgRNA-Cas9系统,该小鼠在其基因组中有60种不同的hgRNA序列。然后,研究人员让表达Cas9蛋白的小鼠与原始小鼠杂交,产生受精卵,受精后hgRNA序列开始切割和突变。
“在受精卵分裂的每一个细胞中,它的hgRNA都有可能发生变异,”第一作者,Wyss Institute和HMS的博士后研究员Reza Kalhor博士解释道,“在每一代中,除了从母细胞中遗传的细胞外,所有细胞都获得了自己独特的突变,因此我们可以通过比较它们具有的突变来追踪相关的不同细胞。”
每个hgRNA可以产生数百个突变等位基因。总的来说,它们可以生成一个独特的条形码,包含成年小鼠中约100亿个细胞中每个细胞的完整发育谱系。
解答关键问题
通过连续记录细胞发育过程,研究人员也可以解决关于胚胎大脑的长期问题——首先大脑是将其前端与后端区分开来,还是先将其左侧与右侧区分开来?

研究人员通过比较两只小鼠脑部不同部位的细胞中存在的hgRNA突变条形码,发现每个脑区左侧的神经元与同一区域右侧的神经元关系更密切,这说明,在中枢神经系统发育的左右patterning之前出现了前后脑patterning。
“这种方法使我们能够进入模型生物体的最终发育阶段,并从那里重建一个完整的谱系树,一直追溯到它的单细胞阶段。这是一个有野心的目标,肯定需要许多实验室几年才能实现,但本文代表了实现目标的重要一步,”Church说。研究人员现在专注于改进他们的读出技术,希望可以分析单个细胞的条形码并重建已记录的谱系树。
“随着时间的推移,能够连续记录细胞历史将成为是发育生物学中的一个重要里程碑,它有望以指数方式增加我们对单细胞生长形成成年动物的过程的理解,如果应用于疾病模型,它可以提供关于疾病如癌症如何出现的新见解,”Wyss研究所创始主任Donald Ingber说。
其它条形码研究进展
Aaron McKenna和同事们开发出了一种叫做GESTALT的谱系追踪方法。这种方法将独特的突变模式引入到了称作为基因组条形码的短遗传序列中。随后利用子细胞中突变条形码的DNA序列来重建细胞谱系关系。
McKenna等在细胞培养物和活体斑马鱼中证实了这一技术的效力。在斑马鱼的胚胎阶段引入条形码,并在成年期分析各种组织,研究人员发现少数的几个胚胎祖细胞生成了构成成体器官的大多数细胞。例如在4月龄的斑马鱼中观察到1,138个基因变异体中只有5个生成了98%以上的血细胞。
作者们指出,在未来的分析中可以利用这一新技术来追踪正常发育中更加复杂的多细胞过程,还可以利用它来鉴别出肿瘤和转移灶的细胞起源。
原文标题:Developmental barcoding of whole mouse via homing CRISPR


{replyUser1} 回复 {replyUser2}:{content}