《柳叶刀》重磅综述:阐述甲基化在医学和生物领域的前沿
DNA甲基化是共价修饰,可以在胞嘧啶核苷酸上发生并且几乎总是在CpG的背景下发生。细胞中广泛的蛋白质系统通过从头甲基化(DNMT3A和DNMT3B)或去除甲基(TET1,TET2和TET3)在DNA上写下甲基化模式,并在DNA期间忠实地复制甲基化模式的一系列因子复制(DNMT1和UHRF1)。除了这些书写工具,细胞含有许多读取DNA甲基化的蛋白质因子(如MeCP2)并将注释转换为功能信息。结果,基因调控序列(例如启动子或增强子)上DNA甲基化的存在抑制了表达。这种抑制是通过甲基识别蛋白系统完成的,该系统募集特异性编程的因子以产生闭合的染色质结构,从而使转录机构不易接近基因。
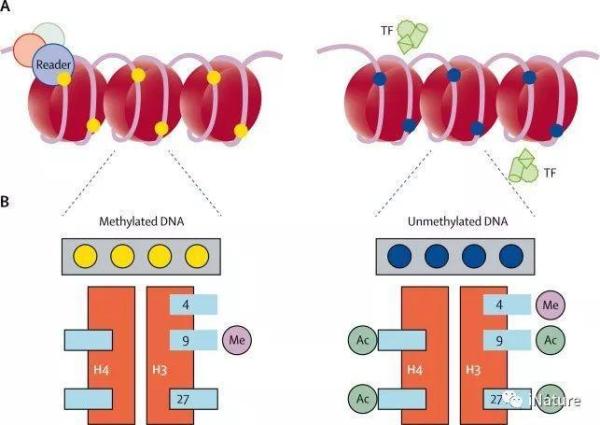
DNA甲基化抑制基因表达
1、重编程
DNA甲基化是一个表观遗传过程。与直接从亲本遗传的DNA序列不同,从配子中提取的甲基化模式在胚胎植入前被删除,每个个体都建立了一个新的甲基化图谱。重置过程分为两个不同的阶段。首先,在植入过程中,除了一大组启动子序列(cpG岛)外,几乎整个基因组都被甲基化了,这些启动子序列(cpG岛)被专门识别和保护,不受这种修饰,因此仍未甲基化。虽然这个事件只发生一次,但由此产生的双峰甲基化模式是通过一个简单的半保守机制在随后的胚胎细胞分裂中维持的。因此,身体中的每一个细胞都携带着这种基础模式.
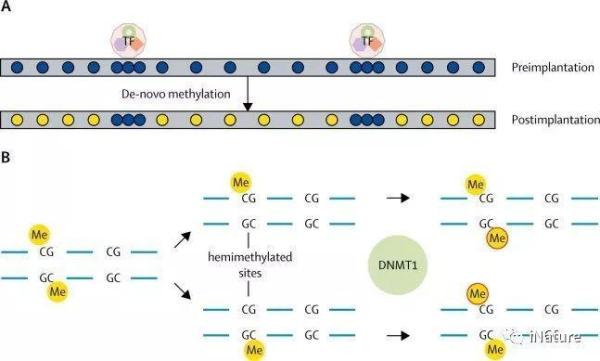
甲基化的基础模式
这一表观遗传过程在建立整个生物体的基本基因表达基础上起着重要的作用。通过使用一个简单的分子程序,只需要很少的识别线索,就会在大范围的抑制在细胞中不表达的序列,包括非组织相关基因和基因组中存在的各种有害病毒序列。这一过程代表了哺乳动物细胞中DNA甲基化的主要功能,并对长寿命生物(如人类)表达模式的稳定性负责。此外,调节许多类管家基因的CpG岛序列优先保持未甲基化,使其在各种细胞类型中表达开放。组蛋白修饰是基因组注释的另一个系统。与DNA甲基化(DNA甲基化)不同的是,组蛋白修饰发生在染色质蛋白上,通常依赖于附近的修饰因子的存在,而这些修饰因子并不是与DNA永久结合的。因此,尽管DNA甲基化是自主稳定的,但组蛋白的变化较少,使甲基化成为细胞记忆的主要机制。
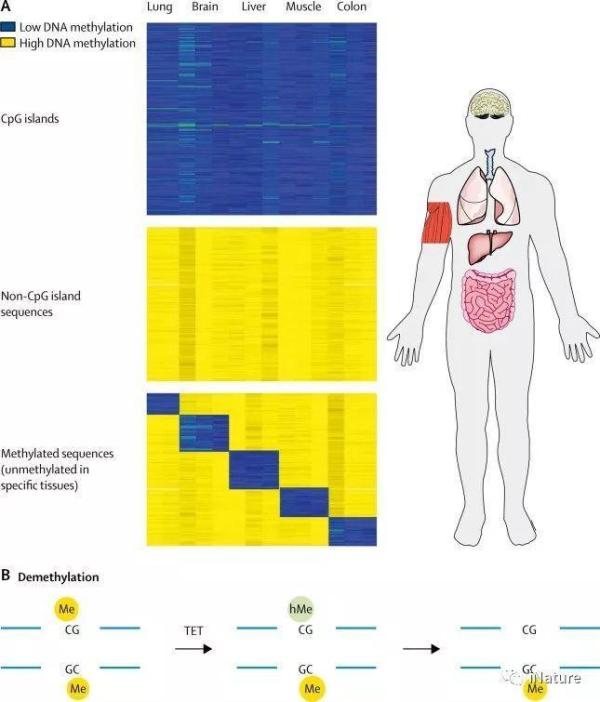
全方位的甲基化模式
甲基化模式重排的第二阶段涉及在基底景观中引入高度离散的变化,这是与细胞谱系分化和器官发生协调发生的过程。一些未甲基化的基因从植入时在特定的发育阶段或特定细胞类型中被关闭后进行从头甲基化。同时,许多启动子和其他关键调控区在组织特异性分化过程中变成去甲基化。在这两种情况下,甲基化的改变都是以程序化的方式进行的,其中包括能够特异性地识别从头甲基化或去甲基化机制的蛋白质因子的序列特异性识别。一旦建立了新的甲基化状态,它就产生了一种组织特异的染色质模板,该模板非常稳定,并维持了生物体的其余部分。该模板是组织特异性基因表达的结构基础。
2、衰老
甲基化事件在发育期间以高度特异性的方式发生,模拟分化组织的表达模式。除了这些编程事件之外,似乎还发生了一个更随机的过程,该过程从胚胎开始并随着时间的推移缓慢地继续,导致基础基因组修饰模式的部分改变。该过程包括由polycomb阻遏物结合的CpG岛组的从头甲基化和基因组的其他区域的去甲基化。这些变化发生在所有组织中,产生一种独特的模式,其随着衰老而增加。实际上,通过测量血细胞中这些部位的一小部分的甲基化状态,可以得出非常准确地反映个体年龄的指数值。
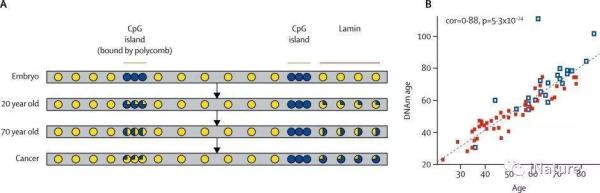
衰老和癌症的甲基化变化
人类和小鼠的实验表明,快速衰老模型中的指数值增加, 表明这种表观遗传学分析测量生物学而不是按时间顺序老化,因此可以反映个体的整体健康状况。事实上,与他们的实际年龄相比,长寿的人似乎有一个年轻的表观遗传年龄。此外,从血液样本中测量的甲基老化时钟被认为是人类全因死亡率死亡时间的有力预测因子。这些甲基化变化是否会影响衰老过程本身尚不清楚,也没有证据表明这种模式受生活方式的影响。
3、疾病中的甲基化
DNA甲基化也在几种人类疾病中起作用。例如,脆性X综合征是由早期发育阶段缺乏FMR1活性引起的。由于FMR1组成型表达,缺陷导致涉及许多组织的症状。在几乎所有情况下,FMR1的缺失不是由于基因编码区本身的突变,而是因为其启动子经历异常甲基化而发生,可能是由于附近的三重重复扩增。这种从头甲基化导致FMR1基因的抑制,其在整个生命过程中保留。DNA甲基化也在几种印记疾病中起着潜在的作用。与大多数基因不同,基因组的印迹区域仅从单个等位基因 - 父本或母本表达。
这种单等位基因表达的发生是因为一个配子(精子或卵母细胞)中的从头甲基化维持到后代的成年期,用于在每个细胞中抑制一个拷贝。诸如Prader-Willi,Angelman或Beckwith-Wiedemann之类的综合症通常由印迹区域的活性等位基因上的遗传畸变引起,从而导致基因表达的完全丧失。在极少数情况下,遗传缺陷会影响负责区域控制DNA甲基化本身的顺式作用序列。由于印迹疾病部分是由异常甲基化引起的基因抑制引起的,因此它们提高了与其他突变产生的缺陷不同的可能性 - 这些综合征可以通过药物或其他在表观遗传水平上运作的干预措施进行治疗。从理论上讲,类似的方法可用于逆转脆性X综合征中的FMR1抑制以及其他遗传性疾病,其中有可能重新激活β地中海贫血或镰状细胞性贫血中的替代基因,如胎儿珠蛋白,或utrophin取代Duchenne肌营养不良症中的肌营养不良蛋白。
4、环境
虽然人们普遍认为环境不会直接影响基因序列,但人们对我们周围事件可能引起表观遗传变化的可能性进行了大量推测 - 例如DNA甲基化 - 这可能会影响长期基因表达模式。在Agouti-Yellow小鼠中可以观察到这种效果的一个很好的例子,它在Agouti基因中具有额外的DNA片段,使它们变成脂肪和黄色。引人注目的是,在怀孕期间喂养母亲额外的维生素(例如,B12,叶酸或胆碱)导致后代的出生具有改变的表型,即使这些动物在遗传上与原始菌株相同。这种效应伴随着在Agouti基因位点添加DNA甲基化,间接地显示了表型如何受到由母体营养变化引起的表观遗传事件的影响。在人类疾病的背景下,临床观察引领了巴克及其同事提出宫内发育迟缓,低出生体重或早产可能与生命后期高血压,冠心病和糖尿病的发展有因果关系的假设。一个突出的例子是,发现接触母体糖尿病的胎儿比成年人更容易患上2型糖尿病而不是未接触过的兄弟姐妹。这些作用也可以通过诸如DNA甲基化的表观遗传机制介导。根据这一想法,在暴露于饮食压力的母亲所生的后代的人和小鼠血液样本中检测到甲基化的微小变化或饮酒在怀孕期间,这些变化似乎与相关的代谢基因有关。
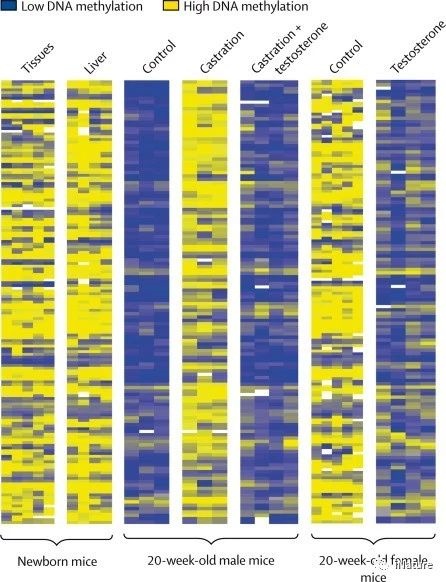
出生后DNA甲基化的变化
出生后也可能发生类似的环境影响。例如,在大鼠中进行的实验表明,在出生后立即由母亲修饰的幼仔也会很好地培养自己的后代。然而,将原始的瞬时体验传递到大脑的适当区域以及DNA甲基化的相关变化是否被用作未来使用的记忆机制的机制尚不清楚。同样,可以问一个问题,即最初的创伤事件如何引起永久性的分子变化,导致生命后期的创伤后应激障碍?这些初始事件是否会导致DNA甲基化改变在适当的细胞类型,记住并用于影响稳定的基因表达?例如,在小鼠中的实验已经表明,化学诱导的炎症引起肠上皮的DNA甲基化的大的变化,这可能使该组织易患癌症。这种思维方式也被用来联系环境影响,如营养,压力或接触有毒物质,对各种疾病的发病机制。
5、诊断人类疾病
DNA甲基化的一个新兴且令人兴奋的临床应用是在诊断领域。垂死细胞将DNA片段释放到血液中,这种无细胞DNA(cfDNA)可用作有价值的诊断工具,称为液体活检。例如,通过分析cfDNA,可以鉴定母体血浆中的胎儿染色体畸变。该方法还用于检测循环肿瘤DNA中的特定突变,用于监测癌症进展或对治疗的反应,甚至在肿瘤不可接近或其位置未知的情况下。cfDNA分析的另一个应用是通过跟踪在受体血液中携带供体基因组的遗传标记的DNA分子来评估移植器官的排斥。
在这些已建立的方法中,基于感兴趣组织(胎儿,肿瘤或移植物)与宿主之间的遗传差异进行诊断。液体活组织检查概念的另一个应用是使用DNA甲基化模式来鉴定cfDNA的细胞类型来源,以一般方式监测特定组织的细胞死亡。事实上,人体中的每种细胞类型都具有独特的DNA甲基化特征,在每个个体中都是相同的,并且在健康和患病细胞的整个生命过程中稳定维持,这使得该特征成为识别死细胞的理想条形码。来自任何特定组织的DNA。
该方法可用于医学中的许多不同应用。例如,可以用甲基化标记监测对肝脏或心脏的病理性损伤,以检测患者血浆中的肝细胞或心肌细胞DNA。原则上,需要鉴定在单个特定组织中未甲基化但在身体的所有其他细胞类型中完全甲基化的基因组基因座(或者,在感兴趣的组织中甲基化和在其他地方未甲基化)。通过使用基于PCR的测定,可以量化血浆中该序列的未甲基化拷贝,指示起源组织中的细胞死亡。由于cfDNA从血浆中快速清除(估计半衰期为15-120分钟),血浆中的组织特异性甲基化标记应反映接近采样时发生的细胞死亡事件。
6、未来的研究方向
虽然我们现在全面了解DNA甲基化在人类生物学中的作用,但仍有许多活跃研究领域与医学密切相关。有大量证据表明饮食或压力等参数可以改变身体许多组织中的甲基化模式,但缺乏对该过程细节及其生理作用的理解。什么是激素样效应物和介导这些变化的信号转导途径以及它们如何调节细胞功能?另外,最重要的问题是这种甲基化是否长期稳定,在此期间它可能改变衰老过程并使个体易患不同的疾病。
此外,一些研究已经表明,父母接触各种环境条件(例如饮食和压力)会影响其后代的长期生理机能。这些影响可能始于父母的生殖细胞的变化,这些变化以某种方式传递给他们的后代。虽然非编码RNA可能在这个过程中起作用,目前尚不清楚这些信号如何产生稳定的标记,这种标记可以影响许多细胞世代后的体细胞。DNA甲基化很可能涉及,但了解其工作原理将需要新的研究方向。
再生医学的基石是人类胚胎干细胞可以在体外分化成任何可以用于替代疗法的细胞类型。将干细胞转化为体细胞组织的一个关键方面是获得适当的表观遗传特征 - DNA甲基化在该过程中起主要作用。控制这些甲基化模式的规则尚未得到充分阐明,但该领域的研究有望找到调节DNA甲基化的人工方法。进展应该能够控制分化过程,使其模仿体内发生的变化。
诸如阿扎胞苷之类的药物单独或与其他制剂组合用于癌症治疗,但这种方法似乎通过在靶细胞中引起广泛的去甲基化而起作用。利用将酶DNA甲基化机制靶向基因组中特定位置的能力的CRISPR技术可以引入DNA甲基化的特定变化以控制基因表达。一旦开发出来,该技术可用于治疗各种形式的癌症和其他以异常甲基化模式为特征的疾病。
原文链接:Principles of DNA methylation and their implications for biology and medicine
来源:iNature
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}