Science爆料:FDA顾问先评审,制药公司后“撒钱”
Science爆料:FDA顾问先评审,制药公司后“撒钱”
写在前面的话:作为一个科班出身又对制药行业抱有极大兴趣和敬意的撰稿人,大部分时候我赞同制药行业为人类的健康和生命做出了伟大的贡献。但随着阅历的增加,我越来越倾向于把制药行业视为一个普通的行业,它的道德光环并不真实,本质仍然是商业活动。既然是商业,就无法避免灰色地带和隐秘的利益链条。这篇故事就是一个很好的例子。
美国食品药品监督管理局(FDA)被公认为各国药品审批管理部门的标杆。多年来,它的业绩确实不负众望。FDA颁布的法规往往被其他国家参考或照搬,绝大部分新药都选择在美国先上市,除了美国市场的巨大诱惑,FDA的专业素质也功不可没。但世界上没有完美的东西,FDA的制度中也有隐藏的灰色地带。
美国FDA。图片来源于网络
FDA审批一款新药是否可以上市的流程非常复杂,今天我只关注最后一步。当一款药物1至3期临床结果全部通过,毒性测试通过,各项生产条件完备,制药公司会向FDA提交上市申请。FDA会按照严格的标准组织一个顾问小组(委员会)对这款药物进行评审并投票,小组成员通常包括医生、科学家和保护患者权益的代表(patient advocate)[1],投票结果会决定上市申请能否获批——FDA一般都会遵从顾问小组的投票结果,但极少数情况下也会有例外。
可以说,上市申请是制药公司“长途奔袭”后的“临门一脚”,而FDA顾问小组就是“守门员”。理论上只有高质量的射门才可以得分,可是,万一“守门员”不合格或者不想合格,那怎么办?
稍有社会经验的人都能想到,顾问小组一定是制药公司重点公关的对象。投票之前塞钱,帮帮忙投个“同意”?太老套了,FDA早有防范,这招很难成功。但制药公司相当聪明,事前不行,那就事后呗。只要顾问们相信这种心照不宣的“许诺”,就知道该怎么选择。
图片来源:STEPHAN SCHMITZ / Science [2]
这可不是我信口雌黄,Science 最近做了一项调查 [2-3],揭露了制药公司和某些FDA顾问间的这点秘密。
Science 的调查对象是2008年至2014年间FDA批准的28种药物背后的制药公司和参与评审投票的107位医生顾问。数据来源有两个:一个是美国医疗保险和医疗补助服务中心的“Open Payments”网站 [4],一个是可公开获取的学术著作中披露的信息。其中,“Open Payments”是美国的一项国家信息披露计划,向公众提供医疗保健系统中各方(制造商、采购方、医生、医院等)之间的经济关系来提升透明度 [5]。这项计划原本应该不是专为药物审批过程而设计,用于支持本次调查稍微有点“意外”。
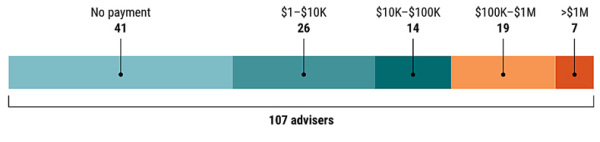
Science 的调查结果表明,这107位FDA顾问在参与过一款药物的评审后,有不少人都能收到制药公司或其竞争对手的钱。这也不奇怪,提交药物上市申请的制药公司当然是希望FDA顾问们投赞成票,而他们有类似产品的竞争对手——当然也是制药公司——明显更想要反对票。也就是说,并不是只有投赞成票的顾问们有可能会在投票后收到好处,那些投反对票的也是一样。给钱的方式也有多种:有些是以科研经费的名义,直接支持那些顾问或者通过其所在机构间接支持;有些则是报销私人的差旅费,支付咨询费,或者干脆就是酬金。人数和金额都相当惊人 [2]:
• 这107名FDA医生顾问中,在投票后的4年内有40人获得过超过1万美元以上的事后收入或研究支持;有26人超过10万美元;更有7人超过100万美元。这些钱来自所评审药物的制造商或其竞争对手。
• 其中17名收入最高的顾问,共收到2600万美元的个人收入或研究支持,平均每人30万美元。
• 收入最高顾问中的大部分人以及很多其他顾问在为FDA提供咨询服务的同一年或前一年就从相关制药公司获得了资金。这些信息由学术期刊披露,而不是FDA。
当然,也有41人是“清白”的,这次调查没有发现他们收过与所评审药物有关联的钱。
图片来源:(GRAPHIC) J. YOU/SCIENCE; (DATA) CENTERS FOR MEDICARE & MEDICAID SERVICES/OPEN PAYMENTS [2]
Science 这项调查除了总体情况的分析之外,还指名道姓地给出了具体的案例。这里仅选择其中两个,拿给诸位看看。
Brilinta案例
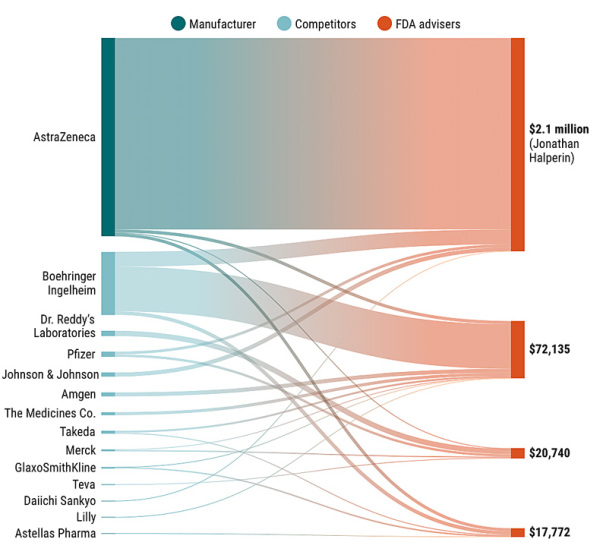
Science 的调查结果表明,阿斯利康(AstraZeneca)的心血管疾病药物Brilinta于2011年7月最终获得FDA批准后的几年内,阿斯利康向参与投票的FDA顾问、西奈山伊坎医学院的心脏病专家Jonathan Halperin支付或报销了20万美元的住宿费、酬金和咨询费,这还不算另外200万美元的研究经费 [2]。要知道Brilinta的上市之路并不顺利,几经起伏,此前在2010年12月这款药物的上市申请恰恰被FDA驳回 [6]。当然,这次的批准也有条件,FDA要求阿斯利康在Brilinta的产品标签上加上“黑框警告”(FDA最高级别的警告),明示其严重出血风险及与阿司匹林联用时效果降低的可能性 [7]。动辄砸出数十万甚至数百万美元,制药公司当然有底气,阿斯利康2017年年报显示,Brilinta仅在当年的销售额就高达10.79亿美元 [8]。数十万甚至数百万美元,与十亿的年销售比起来,也就是九牛一毛而已。
根据Science 的调查结果,四位2010年参与Brilinta评审投票的FDA医生顾问,其后接受阿斯利康和其他制药公司的资金情况如下图所示。
图片来源:(GRAPHIC) J. YOU/SCIENCE; (DATA) CENTERS FOR MEDICARE & MEDICAID SERVICES/OPEN PAYMENTS[2]
明尼苏达大学的医学伦理学家Carl Elliott一直严厉批评制药公司与研究者之间的利益关系[9],他也揭露了这种“心照不宣”的默契,“你做了一件对某个制药公司有利的事情,心里想着他们之后肯定会‘意思意思’。而结果呢?他们真的会这样做。”[2]
耐人寻味的是,FDA拒绝了Science 就此项调查的采访要求。一位发言人在一份声明中称,药物评审顾问小组的成员必须披露的是任何可能的“未来雇主”,而不是预期收入。而且FDA也会筛选潜在参与者的关系和情况,确保这些关系不会造成经济利益冲突。而阿斯利康的发言人Karen Birmingham则否认存在向任何顾问输送利益的行为。[2]
另一个当事人Jonathan Halperin同样否认了阿斯利康的巨额研究经费会让他个人受益。他表示那些经费是给杜克大学的,用来支持一项关于Brilinta的重要研究,他在其中的角色不过是数据监督委员会的主席而已。而他本人在2009年对Brilinta批准的建议并未受到阿斯利康或其竞争对手的金钱影响。Jonathan Halperin还说,这种复杂的关系可能就是“专业”的代价,“与其找一群毫无利益冲突的高中生,可能还找一个在该领域有经验的专家更好。”[2]
Amjevita案例
虽然FDA对于顾问委员会成员的选择有“利益冲突”方面的要求,但显然目前的制度并不能完全避免利益冲突。
2016年一个FDA顾问委员会投票推荐批准安进(Amgen)的类风湿性关节炎药物Amjevita,FDA也遵从了这次投票的结果。这次批准给安进的竞争对手艾伯维带来了麻烦,Amjevita是艾伯维(AbbVie)的重磅药物Humira的生物类似物[10],专家们也都认为Amjevita将会大卖。
哈佛医学院的风湿病专家Daniel Solomon是Amjevita评审委员会的主席。但FDA和Daniel Solomon都没有公开披露,在评审会议召开前3个月,安进为他提供了23.2万美元的经费,用于研究安进的另一款关节炎药物Enbrel。有意思的是,在会议前1个月,艾伯维也向Daniel Solomon提供了高达81.9万美元的经费,用于一项与Humira有关的研究。[2]
Daniel Solomon并不认为这些支持与Amjevita评审有什么利益冲突,他在邮件中表示,这些支持仅仅是业内非常常见的制药公司药物捐赠(drug donations),所属研究是一个NIH支持的研究项目的一部分,他本人也仅仅是这个研究项目中的一个PI。此外,他还称他向FDA披露过这些经费,但没有存底。而FDA则拒绝了信息公开(FOIA)的要求,称这是“对个人隐私明显无理的侵犯”。[2]
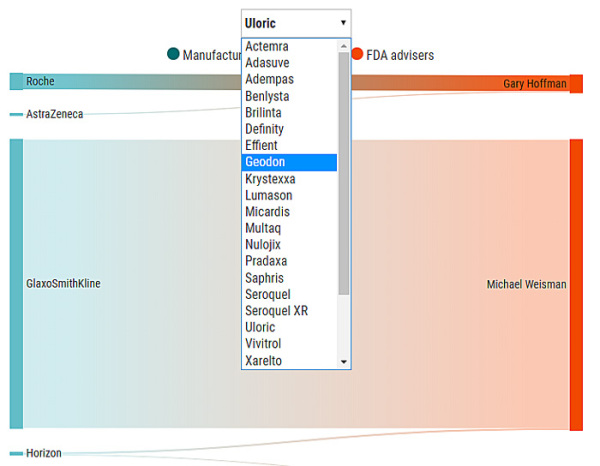
更多的数据可以在Science 网站上看到,本项调查的两位执行者Charles Piller和Jia You制作了非常方便的数据可视化工具[2],选择一种药品名称,把鼠标停在线条上,就能看到各制药公司向FDA评审顾问支付的金额。
图片来源:(GRAPHIC) J. YOU/SCIENCE; (DATA) CENTERS FOR MEDICARE & MEDICAID SERVICES/OPEN PAYMENTS[2]
当然,仅通过这些案例以及调查数据,还不能断定FDA是否知道这些潜在的利益冲突,也不能断定那些顾问在评审中的决定是否受到了制药公司的影响。一些学者也认为,把目前这种“顾问先评审制药公司后撒钱”的关系定义为“利益输送”,仅有这些数据还不能令人信服,而且这种关系也没有违背任何法律法规。
有人建议FDA学习欧洲药品管理局(European Medicines Agency)的做法,后者严格禁止顾问小组成员与制药公司发生经济联系,如果有,至少3年内不得参加该公司有关的药物评审会议。这些经济联系包括制药公司提供的演讲费、咨询费或研究经费等。顾问就算是没有直接收到研究经费,在相关研究中挂名也不行,好比之前Jonathan Halperin的数据监督委员会,也在禁止之列。
如果真这么做,专家们选择成为FDA顾问,将更看重这个职位带来的声望,而非可能的经济利益。实际上在Science 调查的百多名顾问中,47人从制药公司获得的钱少于800美元,还有三四十个人根本没有收一分钱。[2]
尾声:制药公司不是慈善机构,制药公司也不是邪恶组织,不要吹也不要黑。这一行也就是一门特殊点的生意,仅此而已。
参考资料:
1.https://www.fda.gov/AdvisoryCommittees/AboutAdvisoryCommittees/CommitteeMembership/default.htm
3.http://www.sciencemag.org/news/2018/07/methodology-fda-adviser-and-staff-investigations
4.https://openpaymentsdata.cms.gov/search/physicians/by-name-and-location
5.https://www.cms.gov/OpenPayments/index.html
6.https://www.webmd.com/heart-disease/news/20101217/fda-rejects-new-blood-thinner-for-now
7.https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/022433s022lbl.pdf
8.https://www.astrazeneca.com/investor-relations/annual-reports/annual-report-2017.html
9. A lonely crusade. Science, 2014, 344, 793-797
10. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm522243.htm
(本文由氘氘斋供稿)
来源:X-MOL
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。




{replyUser1} 回复 {replyUser2}:{content}