《自然》:科学家首次发现癌细胞竟能将T细胞“囚禁”在骨髓
前不久,我们刚报道了肿瘤能通过释放外泌体远程压制全身的T细胞,造成机体免疫能力下降。
最近,发表在顶级期刊《自然医学》上的文章又显示,肿瘤还有更加“魔幻”的手段攻击人体的免疫系统[1]。
美国杜克大学Peter E. Fecci教授领导的实验团队发现,进入大脑的肿瘤能使T细胞被扣押在骨髓中无法出来。他们证实造成这一后果的原因竟是T细胞出入骨髓的“签证”(T细胞表面的一个受体)丢了[1]!
这一研究可能为辅助癌症药物开辟一个新的探索领域,可以将被困的T细胞从骨髓中释放出来,有助于提高现有和新的免疫疗法的有效性。
目前,Peter教授团队正在与2012年诺贝尔奖获得者Robert Lefkowitz实验室合作,开发恢复细胞表面受体的小分子药物,将T细胞从骨髓中释放出来,辅助T细胞免疫治疗[2]。

Peter E. Fecci Robert Lefkowitz
胶质母细胞瘤(一种脑癌)引起的T淋巴细胞缺少症已经困扰了科学家40年[3]!Peter教授是研究脑癌的专家,他的研究团队发现新确诊、还没接受治疗的胶质母细胞瘤患者的免疫力竟和艾滋病患者一样低下。
健康人体内的CD4辅助T细胞的数量在700-1000(每微升)之间甚至以上,而胶质母细胞瘤病人却只有200甚至更少。同时,其他T细胞相比正常人也有大幅下降。如此低下的免疫功使他们更易受到各种感染,并可能导致癌症恶化。
脾脏是人体最大的免疫器官,内含大量的淋巴细胞。由于脾脏血管狭窄,且发挥清除缺陷型红细胞的功能,常出现损伤[4]。研究者们首先推测T细胞的减少可能是脾隔离症引起的,由此会引发脾脏肿大。可研究结果却与此相反,影像结果显示病人的脾脏有明显的萎缩。
为了方便研究,科学家们构建了胶质母细胞瘤小鼠模型。与人体相似,小鼠血液和淋巴中的T细胞也大幅减少。与此同时,脾脏,胸腺,颈部淋巴节都明显萎缩;不过,研究人员并不清楚这是原因还是结果。
癌症患者的T细胞到底去哪里了呢?是形成受阻?还是“躲在”哪里了?
让我们回顾一下T细胞的产生过程。T细胞起源于骨髓的造血干细胞,经过一步步分化,成为初始T细胞。初始T细胞会转移到胸腺,经过加工成为成熟的T淋巴细胞。随后通过胸腺释放到外周淋巴组织,进而进入人体血液和淋巴循环系统,发挥免疫功能[5]。
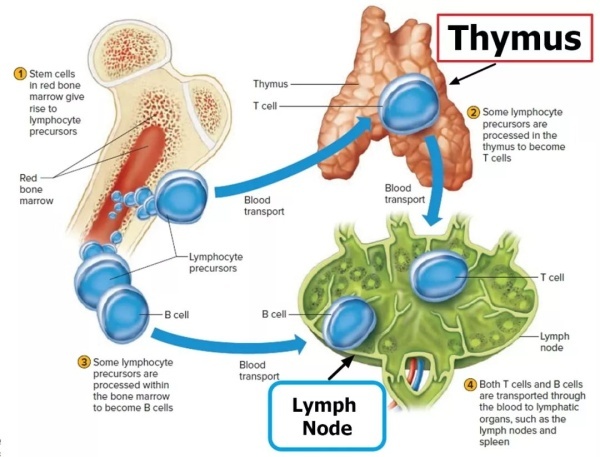
T细胞的迁移路径
接着,科学家们继续开展排查工作。
既然出现了系统性的T细胞减少,那是不是T细胞生产源头出了问题?
于是他们检查了患胶质母细胞瘤小鼠的骨髓,发现小鼠骨髓中的T细胞数量扩大了3 - 5倍!科学家还发现,其他免疫细胞并没有增加,仅仅是T细胞增加了。
这确实出乎意料,于是,研究人员紧接着检查了胶质母细胞瘤患者的骨髓情况,证实在人体中,T细胞也在骨髓中富集。

原来T细胞都挤在骨髓里。
科学家们还将其他肿瘤,如乳腺癌、黑色素瘤、Lewis肺癌和神经胶质瘤分别移植到小鼠颅腔或皮下。实验结果显示,所有移植进颅内的肿瘤都会引起T细胞在骨髓中的聚集,而皮下移植却不会。
这表明,引起T细胞在骨髓中富集的原因并非与肿瘤的类型相关,而是与肿瘤长在哪里有关。看来,问题很严重。
但是它们待在骨髓里作甚?为啥不去抗癌?
对于这个现象,研究人员有这样两个猜测:要么是T细胞倾向于流向骨髓,也就是主动留下;要么它们根本从骨髓里出不来。
究竟是哪种呢?研究人员把从肿瘤小鼠身上收集的T细胞打上标记,分别注射到肿瘤小鼠和健康小鼠体内,再仔细一分析,意外地发现:T细胞心里其实是很像去前线抗癌的,但它们确实是被困在骨髓里出不去了。
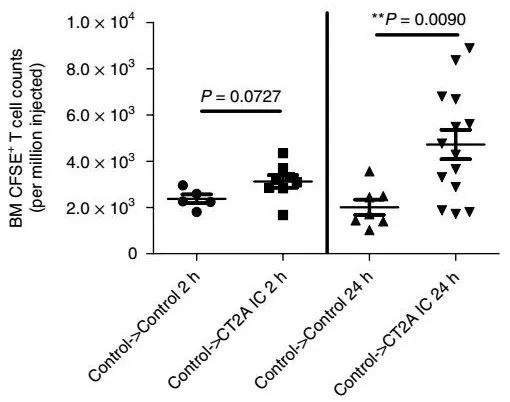
T在骨髓中富集
而且,研究人员还发现,T细胞被困在骨髓里不是骨髓使坏,而是T细胞自身出了问题。
现在,让我们要把目光放在T细胞身上。T细胞表面有大量结构各异的受体,其中多是识别各式各样的抗原以及传递信号等等。同时,T细胞表面的受体还能作为自己的一个身份识别,其中一个作用就是作为进出器官的凭证。
那么会不会是T细胞表面某种受体的丢失导致了其无法离开骨髓呢?在用实验排除了几种可能后,研究人员把目标锁定在了一个叫S1P1的受体上。S1P1是一个G蛋白偶联受体[6],已有报道S1P–S1P1轴能介导T细胞离开骨髓[7]。
他们推测可能是胶质母细胞瘤导致了S1P–S1P1轴的破坏,使T细胞无法离开骨髓。那,我们姑且把S1P1叫“签证”吧。
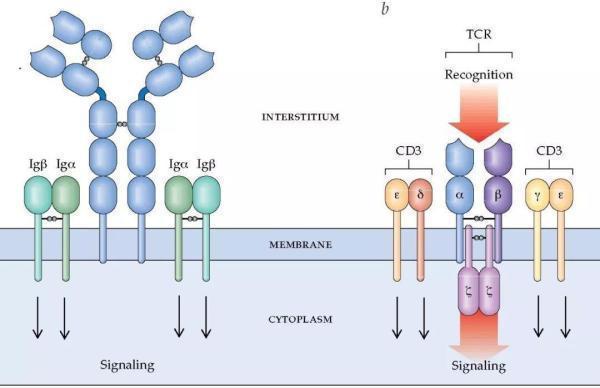
T细胞表面受体
通过一种特殊的检测方法,研究人员发现T细胞表面的S1P1受体水平大大减少!这种表面受体的减少与骨髓中T细胞的数量有强烈的相关性。对小鼠S1P1进行敲除或者药物阻断,也发现了T细胞无法离开骨髓。这些结果表明,确实是T细胞表面“签证”的缺失导致其被锁在骨髓里,无法离开!
不过,在RNA水平的检测显示S1P1的表达并没有差异,其上游的调控子也没受影响,且其在细胞质中的含量也没有变化。似乎不是S1P1表达量减少造成的,只不过是S1P1无法跑到T细胞表面,所以研究人员在细胞膜上检测不到S1P1。
但是,究竟是什么原因造成了T细胞S1P1功能失调,又和进入大脑的肿瘤有什么样的内在联系,目前尚不清楚。这是科学家们之后要做的工作。
不过,还是先让我们回到原来的问题。
既然找到了被困的原因是“签证”丢失,那重新补上签证是否可以获得出境许可呢?
之前已有研究表明,在GRK2蛋白功能缺失的小鼠中,S1P1受体“内部化”会被抑制,S1P1受体会固定在T细胞表面[8]。于是,研究者们在突变小鼠中敲入了过表达的S1P1基因,使T细胞表面的S1P1受体维持在一个固定的水平。
研究人员证实,T细胞表面恢复S1P1受体之后,就变得能自由进出骨髓了,并且还能够增加小鼠体内激活型T细胞进的数量!但是却无法提高肿瘤小鼠的长期生存率。
当研究人员再用4-1BB激动和检查点阻断,这两种T细胞激活疗法一起治疗肿瘤时,T细胞表面S1P1受体固定的小鼠的长期生存率提高了50%!
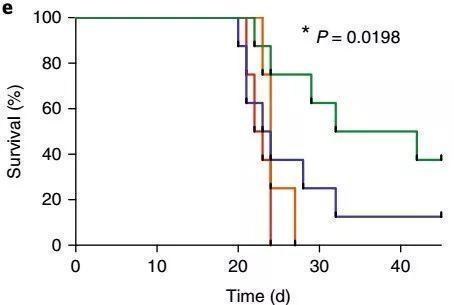
肿瘤小鼠长期生存率提升
由于现在没有药物能将S1P1固定在T细胞表面,研究者们探索了其他方法,来解放被囚禁的T细胞。
他们发现用粒细胞集落刺激因子处理模型小鼠,能使骨髓释放T细胞。只用粒细胞集落刺激因子处理小鼠并没有治疗效果,但与4-1BB激动剂联用使小鼠长期生存率提升了近40%!这意味着,解救被骨髓囚禁的T细胞,在免疫治疗中有巨大的潜力。
科学家们将继续探索颅内肿瘤引起S1P1功能失调,导致T细胞被囚禁的机制。届时,我们将更加了解肿瘤干扰免疫系统的方式,进而找到更好的应对办法!
同时,科学家还在努力开发固定T细胞表面受体的小分子药物,使辅助免疫治疗尽快走向临床。
不仅是胶质母细胞瘤,所有转移到脑内肿瘤的治疗都可能在这一研究中受益。
免疫系统与肿瘤的长久的拉锯战争发展到今天,似乎是肿瘤占了上风。但有科学家和医生以及全体人类的加入,有人类智慧和人类文明的推动,我们正在慢慢扳回局势,终会取得最后的胜利!
引用文献:
[1]Sequestration of T cells in bone marrow in the setting of glioblastoma and other intracranial tumors
[2] https://corporate.dukehealth.org/news-listing /duke-team-finds-missing-immune -cells-could-fight-lethal-brain-tumors
[3] Brooks, W. H., Roszman, T. L., Mahaley, M. S. & Woosley, R. E. Immunobiology of primary intracranial tumours. II. Analysis of lymphocyte subpopulations in patients with primary brain tumours. Clin. Exp. Immunol. 29, 61–66 (1977)
[4] Anie, Kofi A.; Green, John (2015-05-08). "Psychological therapies for sickle cell disease and pain.
[5] Schwarz BA, Bhandoola A (February 2006). "Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis". Immunol. Rev. 209: 47–57.
[6] Hanson MA, Roth CB, Jo E, Griffith MT, Scott FL, Reinhart G, Desale H, Clemons B, Cahalan SM, Schuerer SC, Sanna MG, Han GW, Kuhn P, Rosen H, Stevens RC (February 2012). "Crystal structure of a lipid G protein-coupled receptor". Science. 335 (6070): 851–5.
[7] Maeda, Y., Seki, N., Sato, N., Sugahara, K. & Chiba, K. Sphingosine 1-phosphate receptor type 1 regulates egress of mature T cells from mouse bone marrow. Int. Immunol. 22, 515–525 (2010)
[8] Arnon, T. I. et al. GRK2-dependent S1PR1 desensitization is required for lymphocytes to overcome their attraction to blood. Science 333, 1898–1903 (2011).


{replyUser1} 回复 {replyUser2}:{content}