Nature深度综述:内源干细胞怎样进行组织修复和再生
基于内源干细胞的组织再生疗法是生物技术与医药行业近期兴起的最热门领域之一。科学家们期望能探索干细胞的潜能,使它们修复受损的组织和器官,改善人体健康。尽管大多数动物或多或少都有组织再生能力,但哺乳动物的再生功能远不如许多无脊椎动物,也只有屈指可数的器官能在成年哺乳动物中出现再生。而在其他组织中,损伤往往会导致疤痕的形成,影响身体机能。再生医学的研究要向这一事实发起挑战。
近日,广州妇女儿童医学中心夏慧敏教授和加州大学圣地亚哥分校(UCSD)的两位知名华人学者张康教授与张良方教授在《自然》出版社旗下的《Nature Reviews Materials》联名发表了一篇深度综述,介绍了利用哺乳动物内源干细胞修复组织,剖析了组织再生的机理与研发前景。在今天的这篇文章中,我们也将为各位读者整理这篇综述中的精彩内容。
组织再生,物种有别
众所周知,许多无脊椎动物有着令人惊羡的再生能力,但再生并非是无脊椎动物的专利。譬如,蝾螈这种脊椎动物的再生能力就相当惊人。它们不但能再生出尾巴和四肢,甚至还能再生出心脏、大脑、视网膜等结构。更有趣的是,它们的再生能力并不仅限于幼年期,而是在整个生命周期中都能得到保持。这也让以蝾螈为代表的两栖类动物成为了再生医学的良好模型。

蝾螈有着极强的再生能力
研究表明,蝾螈等动物模型的组织再生涉及到多个复杂步骤,有多种不同来源的细胞参与。以四肢的再生为例,首先,伤口会以无疤痕的方式愈合;之后,未分化的细胞会表现出干细胞的特性,依照组织类型的不同,产生特定的再生功能;最后,这些成年动物会出现类似于胚胎发育的过程,实现四肢再生。
与两栖类动物不同,哺乳动物的再生能力受到一定的限制。总体来看,只有处于发育早期,以及出生后不久的哺乳动物才具有较佳的再生能力,而成年动物组织的再生能力十分有限,会在伤口愈合的过程中形成疤痕,且带来异常的组织重建。少有的几个例外是成年动物的骨骼肌、口腔粘膜、以及大部分肝脏。许多研究提示,成年动物再生能力的下降,可能与免疫系统的发育有关。
越来越多的研究表明,为了修复受损的部位,内源干细胞或局部的去分化细胞会与免疫系统、细胞外基质、可溶生长因子、以及细胞信号进行交流。而在胚胎与成人组织中,这些要素往往有着不同:比如说在胚胎里,细胞外基质中的III类胶原蛋白相较I类胶原蛋白而言,水平要显著增高;而在成人的组织中,这两类胶原蛋白的丰度正好相反。这些不同或许解释了为何在哺乳动物中,胚胎与成人的伤口愈合能力有巨大差别。
干细胞与组织再生
许多研究指出,在组织再生的过程中,干细胞起到了重要的作用。这类细胞经过增殖和分化,发育成具有特定功能的成熟细胞系。根据其分化能力的不同,干细胞又能被分为两类:第一类是多能干细胞(pluripotent stem cells,包括胚胎干细胞和诱导性多能干细胞),第二类是专能干细胞(multipotent stem cells)和单能干细胞(unipotent stem cells,也称成体干细胞)。顾名思义,第二类干细胞的分化能力有限,但它们却在组织再生中扮演了关键角色——组织内的内源干细胞,几乎都是成体干细胞。它们在组织轻微受损后,可协助修复过程,帮助组织恢复正常功能。
在人体内,间充质干细胞是得到最多研究的干细胞之一。这类干细胞有分化成多类细胞的潜力,这包括了骨细胞、软骨细胞、肌肉细胞、以及脂肪细胞。而根据来源的不同,间充质干细胞可以被划分为几种:来源于骨髓的干细胞具有移动到身体远端的能力,且能与免疫系统相互作用,并生产具有生物活性的分子,以创造一个适合组织修复的微环境。因此,它在医疗上具有一定的潜力。举例来说,它有望被用于治疗肌肉、骨骼、心血管、肝脏、肾脏、以及神经系统的疾病。
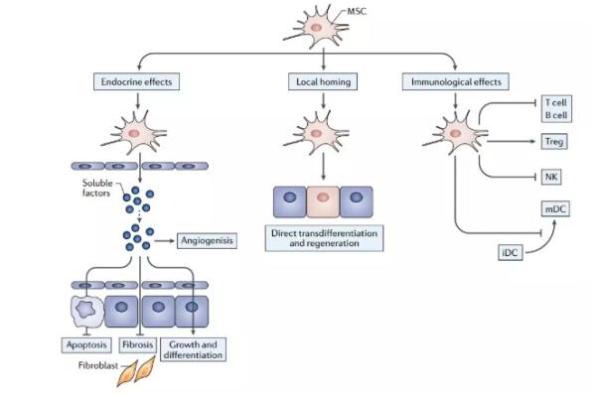
间充质干细胞的信号通路
脂肪与皮肤也是间充质干细胞的主要来源。对人类来说,脂肪组织里有着丰富的专能干细胞,它们能在体内或体外环境下进行分化,可产生多种细胞类型。皮肤作为人体最大的器官,同样是干细胞的一大来源。这两类干细胞同样有着良好的医疗潜力。利用来源于脂肪的干细胞,已成功治疗了一名颅骨多处损伤的患者;而来自皮肤的干细胞也有望治疗诸多皮肤相关的疾病。
除间充质干细胞外,另一些组织来源的干细胞也能对人体组织产生修复作用。第一个例子是晶状体的再生:在移除白内障后,晶状体干细胞在合适的微环境下,能促进晶状体再生;第二个例子是在肝脏中,被激活的干细胞能够增殖、分化成胆管细胞和肝细胞;第三个例子是心脏的再生,众所周知心脏的再生能力较差,这也是心脏疾病难治的原因之一,但在一些案例中,我们依旧在成年哺乳动物中观察到了一定的再生能力。其中的解释之一,就是心脏祖细胞(一类专能干细胞)在发挥作用。
专能干细胞的微环境
专能干细胞的微环境能让组织中的干细胞保持长久的自我更新功能,对于它们执行正常的功能有着关键的作用。目前,已经找到了不少案例,涵盖肝脏干细胞、骨髓干细胞、以及种系干细胞、上皮干细胞、神经干细胞等类型。在对这些案例进行分析后,科学家们发现,尽管涉及到细胞种类有所不同,但这些微环境却有许多相似之处。
具体来说,一个典型的干细胞微环境会包括细胞、细胞外基质、以及可溶性因子(如生长因子)。一般而言,这些适合干细胞的微环境深植于组织内部,以维持特定的氧气、离子、生长因子、细胞因子、以及趋化因子的梯度。
干细胞的分化受到了细胞外基质的影响
科学家们发现,细胞与细胞外基质的相互作用,是干细胞潜力的重要调节与决定因素。不少干细胞位于细胞外基质之中,而后者往往就是干细胞与其子细胞的产物。这些基质由大量分泌蛋白组成,与细胞之间动态互动。人们发现,不同组织或器官的基质有不同的结构特征,往往由其功能所决定。比如对于心脏这一在发育过程中最早获得功能的器官来说,一系列特殊的细胞类型必须在基质中汇集,以配合泵血功能。而在骨骼组织中,基质中的分子则会提供结构上的支持。
而干细胞的分化也会受到基质的影响。基质通过维持其结构的完整性,来维持干细胞的身份,并对它们的激活进行调节。举例来说,细胞外基质刚性的不同,能影响到骨髓干细胞的增殖、迁移、以及分化。此外,除了细胞外基质本身,位于基质中的生长因子和糖蛋白对于干细胞也有重要的调节作用。
用于组织再生的生物材料
本篇综述的主要作者里,张康教授与张良方教授都是生物医学工程领域的专家,夏慧敏教授是生物材料临床应用的小儿外科专家;这篇综述也以相当大的篇幅介绍了如何通过生物工程的方法,促进组织再生。接下来,我们也将介绍这些技术。
1. 生物材料的选择
说到生物材料,首先要考虑到就是它们的组成。常规考虑而言,生物材料可以被分为三类:合成生物材料、天然生物材料、以及合成-天然混合生物材料。合成材料指的是一类具有生物兼容性和生物降解性的多聚分子,其理化和机械性质能与受损的组织相匹配,协助组织再生。举例来说,癸二酸与甘油能聚合成PGS材料,其3D网状结构能很好地模拟天然细胞外基质的可塑性,从而有望用于促进骨髓干细胞分化。
天然材料包括了蛋白质、多糖、以及聚羟基烷酸酯,它们能被用作内源性再生的结构性支架材料。比如BMP7能被载入到I类胶原蛋白组成的支架中,用于治疗患者腓骨缺损。在一项临床试验中,接受治疗的患者在6周后,新骨骼有显著的形成,彰显了这种材料的治疗潜力。
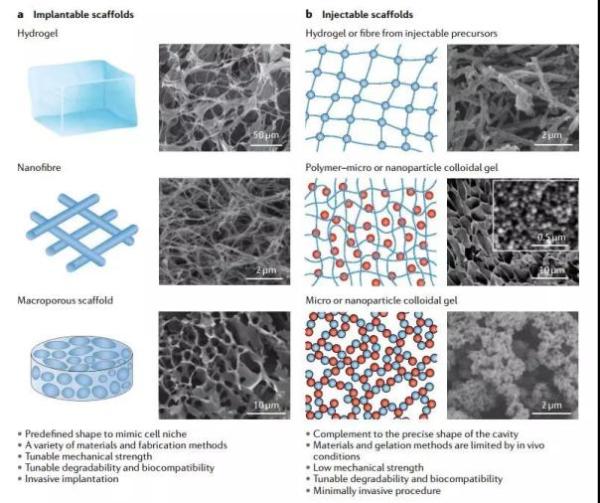
一些可植入和可注射的生物材料
合成材料与天然材料各有各的优势与短板——合成材料不易在人体内降解,可能会引起身体的反应;而天然材料的一些理化和机械属性较弱,且容易被酶所降解。为了取长补短,研究人员们决定将两者进行混合,以求带来更好的生物材料。合成-天然混合生物材料应运而生。目前,我们在这种材料的开发上也已取得了一些成果,比如在聚四氟乙烯的网络上,可以覆盖上一层明胶水凝胶,用于药物分子的递送。
2. 生物材料与3D结构
为了促进组织再生,植入生物体的生物材料必须能模拟细胞外基质的特定特性:它们需要有足够的通透性,让营养与代谢产物可以通过;它们也需要有足够的机械强度,这对于组织再生非常关键。目前来看,与可溶性前体互相交联的水凝胶(可以是合成材料,也可以是天然材料)是一个良好的平台:它们有巨大的“表面积/体积”比,也有很高的孔隙率,能很好地提供类似于生物体的微环境,指导细胞的3D排列,以及组织的de novo(从头)合成。
3D打印技术的进步,则让我们能进一步造出能模拟天然细胞外基质的结构。通过使用生物兼容的材料,我们能使用合适的交联方式,造出可用于内源性再生的支架结构。目前,我们已能用3D打印技术,打印出具有三个不同区域,且区域彼此相连的材料,用于牙周的修复——这种材料的第一部分为100微米的通道,是牙骨质与牙本质的接触界面;第二个部分为600微米的通道,提供给牙周韧带;第三个部分是300微米的通道,供牙槽骨使用。
3. 生物材料与功能
这些生物材料有着许多应用,其中之一就是对能促进组织重生的分子进行包裹与递送。在通常环境下,这些分子不稳定,容易被降解,使得它们的有效期变得较短。而生物材料则能将这些分子包裹其中,并逐渐释放,确保能长期保持所需的水平。目前,人们已经尝试对细胞因子、转录因子、以及调控性的趋化因子进行包裹与递送,并能通过改变生物分子的一些理化性质,对内容分子释放的动力学进行调控。
对于另一些信号分子来说,将其附着于支架表面,能有利于其执行功能,改善细胞的附着,促进细胞的增殖,甚至指导细胞的分化。
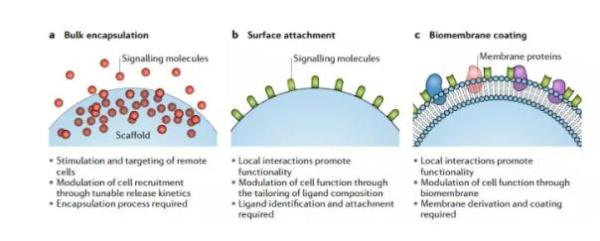
生物材料的一些应用
除了以上两方面外,生物材料还有许多其他的潜在应用。譬如,我们可以在纳米纤维的支架外附上合成的脂双层,将这些纤维与外部环境隔绝开。这样一来,脂双层表面的蛋白有望更好地与受体相结合。另一些研究指出,天然衍生的细胞膜能有同样的作用。而细胞膜包裹技术,许多具有疗效的纳米颗粒有望诞生,造福患者。
结论与展望
特定生物的组织与器官自我再生能力,为我们提供了关于再生微环境的重要洞见。我们已经从中找到了不少生化调节因素,而生物物理因素则还有待进一步阐明。对于这些因素的整合,有望让我们能更好地操控干细胞,在体外,甚至是体内环境中进行组织再生。
在生物材料的工程化以及在干细胞生物学上的进步,能为我们带来全新的生物材料,满足干细胞的特殊需求,让关键细胞因子与细胞得以更好地互动,最终促进干细胞的激活与组织的再生。
我们期待,随着科学的不断发展,我们有朝一日能真正实现人体的组织再生,让由于先天性残缺、创伤、或是肿瘤引起的组织损伤得到修复。我们期待这一天的尽快到来!
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}