前沿 | 新机制 Tau蛋白如何损害阿兹海默病患者的脑细胞
淀粉样蛋白沉积和由tau蛋白构成的神经原纤维缠结是阿兹海默病(AD)最典型的病理特征。淀粉样蛋白和tau蛋白导致AD发病的机制也一直是科学家们研究的重点。近日,由麻省总医院(Massachusetts General Hospital,MGH)和约翰霍普金斯医学院(Johns Hopkins School of Medicine)研究人员领导的最新研究发现了tau蛋白扰乱大脑细胞正常功能的新机制。在最新一期的《Neuron》期刊中,他们描绘了tau蛋白如何干扰大脑神经元的细胞核与细胞质之间的交通。
“细胞核与细胞其它部分之间的交通是一个受到严格调控的过程,”这项研究的共同资深作者之一,MGH的Bradley Hyman博士说:“我们的研究揭示了tau蛋白损伤大脑细胞的新途径。在其它系统中,扰乱这一交通过程会导致细胞功能失常甚至细胞死亡。因此,我们认为它可能也会导致AD中神经元的功能失常和死亡。”
在这项研究中,科学家们利用从AD患者中获取的神经元和tau蛋白病理的细胞模型,对tau蛋白和组成核孔复合体(nuclear pore complex, NPC)的蛋白之间的相互作用进行了研究。细胞的核膜上存在着由30多种核孔蛋白构成的NPC,它们是各种分子进出细胞核的通道。小分子通常可以自由地进出NPC,但是大分子需要与它们的受体和核孔蛋白相互作用,才能凭借主动运输进出NPC。
研究人员发现,与AD相关的磷酸化tau蛋白能够与一种名为Nup98的重要核孔蛋白相结合。而这一相互作用会导致Nup98错误地分布到细胞质中。在细胞质中的Nup98蛋白会促使tau蛋白形成神经原纤维缠结。
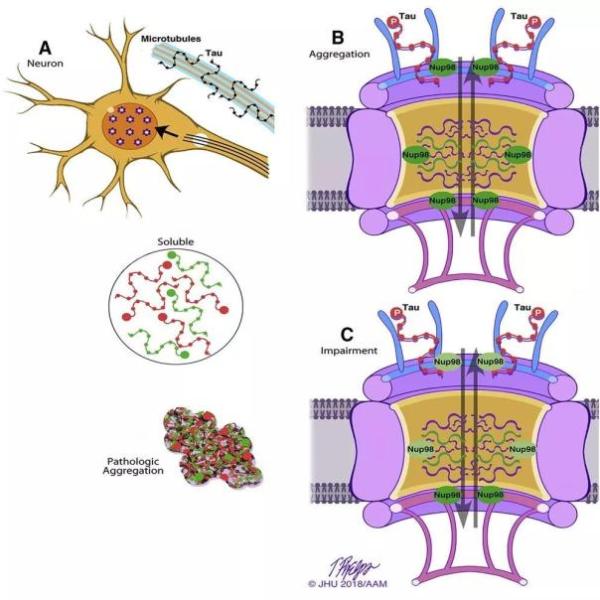
Tau蛋白与Nup98结合导致tau蛋白聚集和核孔复合体功能失常
另一方面,神经元的NPC功能出现失常,导致很多原先无法进出的大分子能够自由进出核孔。负责主动运输大分子的Ran酶从神经元细胞核中泄漏出来,而且细胞核的形状和结构也出现了变化。在过度表达tau蛋白的小鼠模型中,研究人员也观察到了类似的现象。而抑制tau蛋白的过度表达会恢复细胞核中Ran蛋白的水平和核膜中的Nup98水平。
“这些发现让人兴奋的一点是,如果我们可以阻断tau蛋白和核孔之间的相互作用,这可能让患者大脑中现存的神经元更好地发挥它们的功能。这将是我们下一步的努力方向之一。”Hyman博士说。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}