Cell:肠道免疫微环境
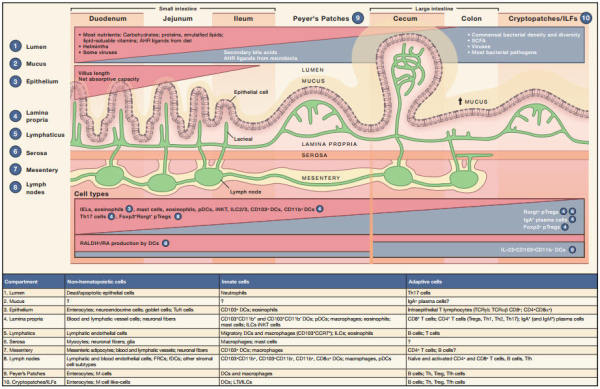
肠道微环境会根据肠道内的物质和组织功能,沿着近端-远端的组织壁发生改变,相应的也可以在每个肠道微环境中发现高度特异化的免疫区室。Cell最新一期以“SnapShot: Gut Immune Niches”为题介绍了这方面的内容。
肠道免疫细胞有个“低电量模式”
你的肠道每天都需要在一个协调的平衡中工作——确保基本营养素吸收的同时阻止潜在有害微生物进入。检测该系统的是一组特殊的免疫细胞,尽管它们有许多活化细胞特征,但是由于某些未知的原因它们似乎被身体“雪藏”了。
葡萄牙João Lobo Antunes分子医学研究所的Marc Veldhoen团队阐述了这些细胞的不同组成通过降低细胞产能能力,使它们处于受控制的激活模式。这一知识点为消化道炎症诊断和治疗提供了一个新切入点。
在我们身体外层——皮肤和肠道——含有一组特殊的白细胞群,我们称之为上皮内淋巴细胞(intraepithelial lymphocytes)。这些细胞不是完全激活也不是静息的,有关它们的活性是被如何控制的,在很大程度上是未知的。
利用成像和生化实验,Marc Veldhoen领导的研究小组证明,线粒体差异可能是影响这些细胞活性的部分原因。
利用高倍放大显微镜,观察图片显示虽然细胞中线粒体数量非常丰富,但结构似乎与普通光镜染色不同。“当我们分析结构细节时,我们发现将线粒体与细胞其他部分分隔开的层的脂质发生了变化,”文章一作Špela Konjar说。“这些变化使线粒体工作的方式发生改变,让它们处于一种‘低电量模式’。”
接下来,研究人员进一步分析线粒体功能。他们证实,当脂质层结构被定向改变后,细胞激活潜能也相应发生变化。换句话说,细胞线粒体脂质可操纵细胞的代谢状态,甚至改变细胞活性。
“一旦线粒体脂质排列与其他白细胞不同,细胞就无法在被需要时适当激活,”研究人员解释说。“这一新知识点为我们提供了抑制或激活细胞活性的新途径。另外,线粒体检测也可作为肠道白细胞激活状态的诊断标志物。”
人体“防御”系统帮助细菌生长
多年来,免疫学的研究背景大多围绕病原菌。肠道的情况却十分复杂,数十亿细菌中的大多数都在努力不让你生病。
一项研究表明,肠道细菌也涉及积极的免疫识别,但是,免疫系统的目的不是绞杀它们,而是保护它们。免疫系统不仅仅是防御系统,抗体也不只是武器。
加州理工大学的一项新研究阐明了一种有益细菌利用人类免疫反应让自身舒服地安顿在肠道内的基本原理。
过去十几年,许多研究在疾病、生活方式、地理和出生等各种情景下剖析了肠道菌群。科学家已经了解到,微生物群落的组成影响着包括炎症性肠病、自闭症和帕金森症等多种疾病。
迄今为止,有关微生物群落的建立和维持,在很大程度上仍是未知的。这项研究揭示了特定有益细菌与免疫系统合作,从而促进长期肠道定植的分子机理,这一发现将转化为微生物菌群失调治疗新方法,或许可以预防或治疗多种人类疾病。


{replyUser1} 回复 {replyUser2}:{content}