复杂的T细胞命运,《Science》透露免疫应答细节
当一种病原体感染人后,免疫系统立即以一系列复杂(非常复杂)的事件作出反应。
一些被称为淋巴细胞的免疫细胞迁移到感染部位,另一些则迁移到淋巴结中,这里是抗体生产区。通过细胞间接触和信号分子释放,免疫细胞之间进行大量信号传导,这些反应的目标是破坏病原体和修复组织损伤。
在应答过程中,许多免疫细胞成熟为具有增强功能的细胞,从而使它们以特异性的方式应答特定类型的病原体,这被称为“效应细胞分化”。
对一种名为滤泡辅助性T细胞的免疫细胞来说,了解效应细胞分化机制可能是生产疫苗的关键,而疫苗可以帮助我们更好地对抗难缠的病毒、细菌和多细胞病原体,或者控制自身免疫性疾病。
阿拉巴马大学伯明翰分校的研究人员和其他4个美国研究机构合作在《Science》发表了一篇文章,详细论述了一种决定两类主要效应细胞(滤泡辅助性T细胞和非滤泡辅助性T细胞)命运的新机制。
滤泡辅助性T细胞(T follicular helper cells,Tfh)和非滤泡辅助性T细胞(non-T follicular helper cells,non-Tfh)都是从淋巴结表达表面标志物CD4的幼稚T细胞发展而来,但是,当激活信号宣布体内有部位感染,幼稚T细胞就会发育成Tfh细胞或任意一种non-Tfh细胞(Th1、Th2或Th17)。
Tfh细胞迁移至淋巴结的B细胞区,与B细胞相互作用形成生发中心,B细胞产生并释放特异性靶向病原体的高亲和力抗体,抗体是适应性免疫的一个分支,通常距离感染时间有几天到几周的延迟。
另一方面,non-Tfh细胞迁移至病原体感染病灶(非淋巴组织部位),协调适应性免疫的另一个分支——增强先天免疫细胞功能。
在效应细胞分化的早期事件中,已知活化的CD4+T细胞亚群生产细胞信号白细胞介素-2(IL-2)。由于研究人员没有标记物来区分哪些活化细胞正在生产IL-2,因此无法将Tfh细胞与non-Tfh细胞区分开来。
Casey Weaver课题组在遗传工程改造IL-2报告小鼠身上找到了答案。这些小鼠的IL-2基因关联绿色荧光蛋白基因,一旦T细胞开始产生IL-2,蓝光下的细胞就会呈现绿色荧光。IL-2生产细胞和非IL-2生产细胞自动被分选为两个不同的组。随后2-3天,报告小鼠体内的Tfh和non-Tfh细胞也可被区分开来。
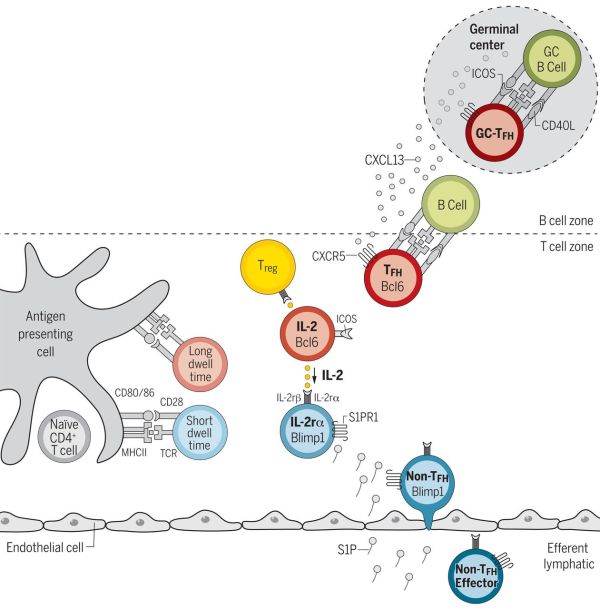 文章一作Colleen Winstead博士发现,每组细胞诱导了不同的基因子集,IL-2生产T细胞的诱导基因对Tfh细胞发育和功能十分重要,相反,非IL-2生产T细胞的诱导基因经过表征与non-Tfh效应细胞分化有关。这表明,IL-2生产者注定成为Tfh细胞,而非IL-2生产者注定成为非Tfh效应细胞。这样的命运决定似乎在数小时内就已达成,甚至在活化的T细胞分裂开始之前。
文章一作Colleen Winstead博士发现,每组细胞诱导了不同的基因子集,IL-2生产T细胞的诱导基因对Tfh细胞发育和功能十分重要,相反,非IL-2生产T细胞的诱导基因经过表征与non-Tfh效应细胞分化有关。这表明,IL-2生产者注定成为Tfh细胞,而非IL-2生产者注定成为非Tfh效应细胞。这样的命运决定似乎在数小时内就已达成,甚至在活化的T细胞分裂开始之前。
其他研究机构的研究人员设计了另一种报告小鼠来证明这种命运决定。第二个报告基因也与IL-2基因相关,它特异性地在IL-2生产T细胞表面创建一个标记,当使用与其结合的抗体选择性移除这些IL-2生产细胞后,就会导致Tfh细胞“绝产”,只剩下non-Tfh细胞。
在Weaver的领导下研究人员还进行了一系列实验,以揭示控制CD4+T细胞早期分化为Tfh和non- Tfh效应细胞的机制。
结果显示,Tfh细胞的百分比与用于激活幼稚CD4+T细胞的抗原数量和抗原-受体结合强度有关。IL-2生产受细胞接收到的T细胞受体信号强度限制。
“所以,这取决于激活强度和信号强度,”DiToro说。“了解Tfh细胞发育过程,如今我们可以操纵这些强大的细胞,促使B细胞生产高亲和力的抗体。”
研究小组还发现,Tfh细胞和non-Tfh细胞分化还可以通过诱导上调高亲和力的IL-2受体组分基因进行转变。
其中,IL-2生产细胞上调的基因包括Bcl6,它对Tfh细胞发育非常重要。三种类型的non-Tfh细胞对不同病原体起反应,Th1对应病毒或细菌病原体;Th2对应多细胞生物(例如寄生虫);Th17对应胞外单细胞病原体(如大肠杆菌)。
研究人员刺激幼稚CD4+T细胞诱导Th1、Th2或Th17发育,他们发现,Bcl6和IL-2生产互为反映。随后,他们采用多种体内炎症模型来证明,不管是否存在炎症,IL-2生产细胞都能发育为Tfh。
于是,研究人员对另一类名为记忆细胞的效应T细胞进行了预测,这些细胞可以存活较长时间,让机体尽快对曾经感染过的病原体起反应。研究人员预测,非IL-2生产者的最终命运是效应记忆T细胞,而IL-2生产者的命运则是中央记忆T细胞。中央记忆T细胞主要分布于淋巴结,效应记忆T细胞缺乏归巢淋巴结的能力,并滞留在外周血和组织中。
“IL-2是一种早期标志物,适用于回答细胞命运可能走向哪个效应程序,”研究人员写道。“我们的这项研究为调节效应T细胞平衡提供了基础依据,最终将导致更好的治疗策略。”


{replyUser1} 回复 {replyUser2}:{content}