Cell突破丨人类骨骼干细胞终于被鉴定出来

骨骼是一种精密而活跃的器官,它由骨、软骨、脂肪、成纤维细胞、神经、血管和造血细胞的多种组织构成,且具有一定的再生潜力。骨骼功能障碍可引发许多疾病,从骨质疏松症、骨关节炎等年龄相关的常见病,到非愈合性骨骼损伤、血液疾病,甚至癌症都可能和骨骼问题有关。目前改善骨骼功能的相关治疗方案仍十分有限,主要原因之一是我们对人类骨骼系统中的干细胞调节机制了解十分有限。
骨骼中的每种组织类型的产生和维持都离不开相应干细胞的精确调节,这些干细胞具有分裂和分化产生不同细胞谱系的能力。其中,研究最透彻的是造血干细胞(hematopoietic stem cell,HSC),其具有典型的细胞表面蛋白组合,可在体外培育形成细胞群落,在体内具有长期造血,即产生各类血细胞的功能。
骨骼组织中还可能存在另一些干细胞,作为非造血细胞系(如骨、软骨、血管内皮和基质)的起源。长期以来,学界致力于在人类骨骼中鉴定出这些假设存在的干细胞,却一直难以确定可靠的细胞表面标志物、合适的组织解离方案和功能性干细胞试验。最早,人们只能在培养基上培养分离出的骨骼“间质干细胞(mesenchymal stem cells)”,它们由多种类型的干细胞组成,而不是最原始的骨骼干细胞(skeletal stem cell,SSC)。后来,骨骼干细胞上特定的表面蛋白陆续被发现,它们在分化过程中表达出相应的功能,CD146+细胞甚至可以在小鼠里重建出具有造血功能的人类小骨。然而,这些过去研究中表达标记蛋白的细胞,在功能上终究是异质性的,不能反映人类骨骼干细胞层级系统的实质。
2015年,通过谱系追踪和克隆分析等手段,科学家找到了小鼠骨骼干细胞(mouse SSCs,mSSCs)存在的证据。最近,人类骨骼干细胞(human skeletal stem cell,hSSC)终于被首次鉴定,该工作于9月20日以Identification of the Human Skeletal Stem Cell为题发表在Cell杂志上,由斯坦福医学Michael T. Longaker团队完成。这项工作主要包括hSSC的分离和相关功能检验、个体hSSC基因表达分析以及驱动骨骼发生过程的进化趋同或趋异通路分析。

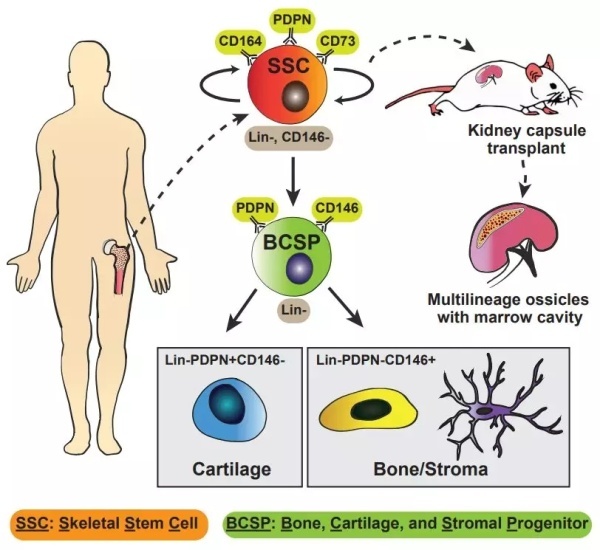
首先,研究发现了人类骨骼干细胞的发展层级。hSSC的标志性蛋白由PDPN、CD146、CD73和CD164组成,纯化出的PDPN+CD146-CD73+CD164+细胞群落,在体外具有自我更新的能力(该研究通过连续产生细胞群落形成单位(colony forming units,CFUs)的能力表征),在小鼠肾下移植,能够线性地分化出含有骨、软骨和基质的多向性小骨(multilineage ossicles):首先分化出早期骨、软骨和基质的祖细胞(hBCSP),接着是骨祖细胞(hOP)和软骨祖细胞(hCP),最后才分化出骨骼、软骨和基质细胞。值得注意的是,hSSCs不会分化为脂肪细胞(表明脂肪细胞可能来源其他常驻的骨髓干细胞)。
通过新建立的人骨异种移植小鼠模型(将18周胎儿带完整骨膜的指骨移植物移植到5日龄的免疫缺陷NSG小鼠中所得),研究者在相对可控的环境中评估了损伤对人体肢体骨骼的影响。研究发现,在急性骨骼损伤后,hSSCs会在损伤部位发生显著的局部扩张,这证明了hSSCs作为干细胞对骨骼损伤的再生反应。
关于造血支持功能的试验表明,hSSC分化出的基质可以在无血清培养条件下维持人造血干细胞(hHSCs)的生长。研究者还发现了hSSCs和hSSC衍生细胞群能够表达多种潜在的造血支持细胞因子,包括ANGPT1,CSF1,SDF,IL27,IL7和SCF;对应的,hHSCs也表达了多种可能支持hSSC细胞系的因子,包括BMP2,BMP8A,DHH,FGF3,WNT1和WNT8。
第二,研究发现,hSSC及其下游分化细胞不仅可以从胎儿和成人的骨骼中成功分离,也能够从BMP2处理的人脂肪基质(BMP2-treated human adipose stroma,B-HAS)和诱导多能干细胞(induced pluripotent stem cells,iPSC)中获得。通过scRNA-seq定量分析,发现胎儿和成人的hSSCs分化时的基因表达存在差异,可以一定程度解释不同来源hSSC形成的小骨中,软骨和骨的比例不同的现象。
第三,该研究通过比较小鼠和与人类SSCs在转录组学和表观遗传学上的区别,发现了干细胞介导的骨骼形成在进化上保守的调节通路,以及另一些趋异的分子通路,后者可能在骨骼发育中起到调节物种特异性的作用。
研究图解摘要
总的来说,通过对小鼠和人类SSC及其下游骨骼细胞谱系的鉴定,这项研究为我们描绘出干细胞介导的人体骨骼组织形成的细胞谱系图,为未来研究骨骼形成、发育的遗传和分子决定因素打下了基础,推进了骨骼疾病分子诊断和治疗的发展,有利于缓解退行性、肿瘤性、创伤后或手术后的多种骨骼疾病给人类带来的巨大医疗负担。
来源:BioArt
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}