一种潜力新药可逆转小鼠全身性胰岛素抵抗
一项研究表明,氧化磷酸化降低的脂肪组织巨噬细胞表现出巨噬细胞M1样极化,以及脂肪炎症和系统性胰岛素抵抗。文章发表于《Nature Communications》杂志。

韩国忠南国立大学医学院内分泌与代谢研究中心 Minho Shong和Saet-Byel Jung等人利用转基因工程小鼠,发现CR6相互作用因子(CR6-interacting factor 1,Crif1)的髓系特异性丢失导致巨噬细胞线粒体氧化功能受损,小鼠就会发展出脂肪炎症相关系统性胰岛素抵抗,换句话说,巨噬细胞氧化功能降低是机体发展为系统性胰岛素抵抗和脂肪炎症的决定性因素。
脂肪组织巨噬细胞(adipose tissue macrophages,ATM)是人体和小鼠脂肪组织中较为丰富的免疫细胞,最近科学家们发现,ATMs参与肥胖诱导性脂肪炎症和全身性的胰岛素抵抗。已知ATMs的氧化功能控制着其M1样(经典活化的)和M2样(选择性活化的)表型,但是,研究人员对其氧化功能是否以及如何导致了患者体内胰岛素抵抗,目前尚不清楚。
M1样巨噬细胞主要分泌促炎因子、M2样巨噬细胞表达抑炎因子负责抑制炎症反应以及组织修复。过去,Crif1被认为是氧化磷酸化(OxPhos)亚基生物起源的必需线粒体核糖体(mitochondrial ribosome )因子。M2样巨噬细胞的氧化代谢依赖分泌因子“生长分化因子15(growth differentiation factor 15,GDF15)”。
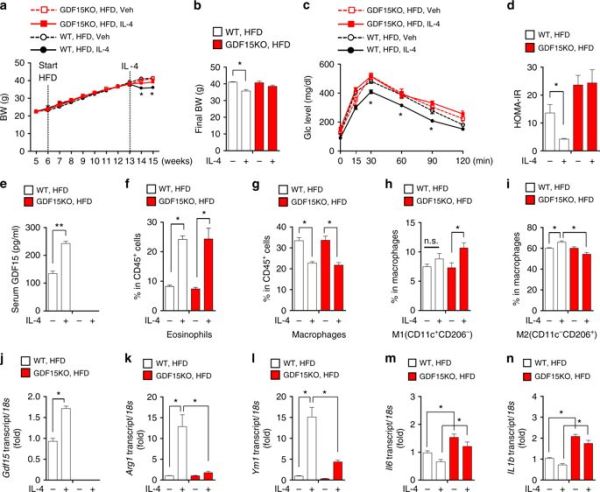
当研究人员抑制M1样巨噬细胞表达GDF15后,脂肪炎症和胰岛素抵抗增强。反过来,GDF15由于可以上调巨噬细胞氧化功能,导致了M1样细胞极化为M2样表型,并可逆转缺乏Crif1基因小鼠高脂饮食(HFD)作用下的胰岛素抵抗。
相反,GDF15缺乏巨噬细胞会极化成M1样表型,当研究人员将缺失GDF15的巨噬细胞补回到巨噬细胞已被药物耗尽的HFD小鼠体内后,小鼠立刻产生了葡萄糖不耐受。
给肥胖小鼠服用GDF15可以改善脂肪巨噬细胞氧化功能,逆转了胰岛素抵抗。“我们的研究表明,巨噬细胞线粒体氧化功能缺陷导致系统性胰岛素抵抗和脂肪组织炎症,”文章作者写道。“线粒体OxPhos功能缺陷使其失去GDF15分泌能力,作为巨噬细胞调节自分泌和旁分泌信号因子,GDF15在白色脂肪组织中对抗炎起积极作用。”
文章主要研究手段,氧化代谢分析采用了Seahorse XF-24 分析仪(Seahorse Bioscience Inc., North Billerica, MA, USA)和 Seahorse XF-24软件。
 根据美国医学协会杂志报道,中国1.14亿人口已被确诊为糖尿病患者,其中95%属于致病机理为胰岛素抵抗和胰岛素分泌不足导致的II型糖尿病,除了补充人胰岛素,近年来,以GLP-1受体激动剂为代表的小分子药物逐渐崭露头角。这项新研究鉴定了GDF15对改善系统性代谢稳态和肥胖患者的治疗潜力,为新药开发铺平了一条可行途径。
根据美国医学协会杂志报道,中国1.14亿人口已被确诊为糖尿病患者,其中95%属于致病机理为胰岛素抵抗和胰岛素分泌不足导致的II型糖尿病,除了补充人胰岛素,近年来,以GLP-1受体激动剂为代表的小分子药物逐渐崭露头角。这项新研究鉴定了GDF15对改善系统性代谢稳态和肥胖患者的治疗潜力,为新药开发铺平了一条可行途径。


{replyUser1} 回复 {replyUser2}:{content}