盘点:新型CAR-T技术治疗实体瘤的临床研究进展
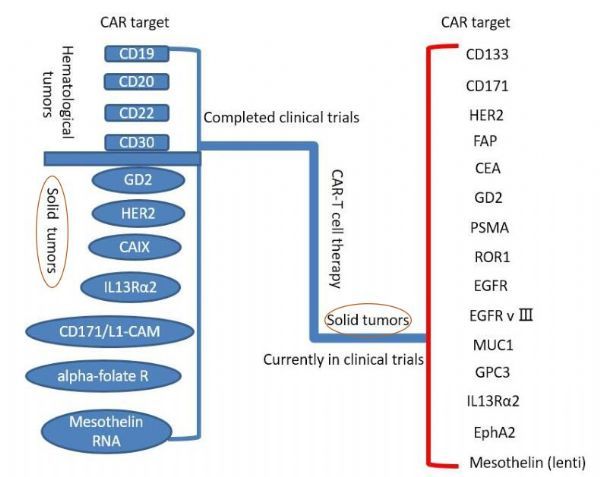
CAR-T 细胞疗法在血液肿瘤治疗中取得的空前成功激励着科研人员把这一技术扩展应用到实体瘤上,越来越多的针对实体瘤抗原的CAR-T 细胞疗法临床试验相继开展:靶向神经节苷脂GD2治疗神经母细胞瘤,靶向间皮素治疗胰腺癌以及靶向癌胚抗原(CEA)治疗结直肠腺癌等。
血液肿瘤和实体瘤:已完成和正在进行的CAR-T临床试验(图片来源 Oncotarget)
然而,大多临床试验的初步结果却不尽如人意,有效性远远低于CAR-T治疗血液肿瘤,且常伴随毒性。尽管如此,众多的科研工作者对于CAR-T在实体瘤方面的尝试却从未停止,他们长期致力于CAR-T的改造和优化,以期将更多的适应症纳入到这一突破性技术的治疗范围中。
临床前研究阶段
1 装备迷你版PD-1抗体的CAR-T
2018年8月13日,由Eureka Therapeutics (优瑞科公司)和MSK共同合作的一项关于新型CAR设计的研究发表在Nature子刊《Nature Biotechnology》上。
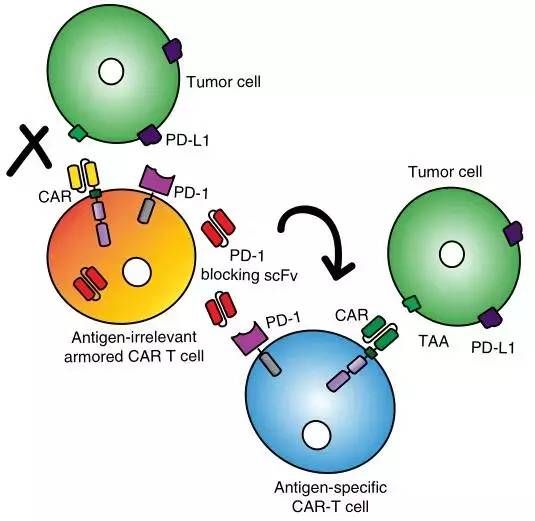
分泌PD-1单链抗体的装甲CAR-T细胞(图片来源 nature)
论文中表明:新设计的CAR-T细胞能够分泌一种迷你版本的检查点阻断抗体(ScFvs are smaller),该抗体类似于PD-1抗体药物Opdivo和Keytruda,能够结合一种被称为PD-1的蛋白质。基于此,MSK联合优瑞科团队制作了两个版本的“装甲CAR”。其中一个以CD19为靶点,CD19 在大多数B细胞血液肿瘤表面表达;另外一个是以MUC16为靶点,其在一些卵巢癌和胰腺癌中表达。
小鼠实体瘤模型显示,“装甲CAR”在体内的持续时间均比标准CAR更长。同时,还产生了更好的治疗结果,相比较于传统CAR,小鼠的寿命获得了显著延长。更重要的是,因为检查点药物直接释放到肿瘤中,激活附近的T细胞,从而创造了一个有利的旁观者效应。换句话说,就是CAR- T细胞能够获得其他T细胞的帮助以对抗肿瘤。
2 针对致命脑瘤的EGFR/EGFRvIII双靶点CAR-T
2018年9月,上海交通大学医学院附属仁济医院、上海市肿瘤研究所癌基因及相关基因国家重点实验室的李宗海/蒋华课题组与科济生物医药团队合作在肿瘤领域国际著名学术期刊Cancer Immunol Res在线发表了题为《Selective Targeting of Glioblastoma with EGFRvIII/EGFR Bi-targeted Chimeric Antigen Receptor T Cell》的研究论文。
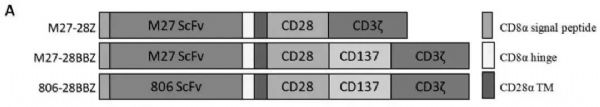
EGFR/EGFRvIII双靶点CAR-T细胞的构建
在该项研究工作中,该团队开发了一个人源化抗体M27,可以同时识别肿瘤细胞中的EGFR和EGFRvIII,但不识别正常组织中的EGFR,这样既做到一箭双雕,而且可以避免在靶脱瘤的毒副反应。体外试验表明,该CAR-T细胞对于EGFR或EGFRvIII高表达的肿瘤细胞可以有效杀伤,但对高表达EGFR的正常细胞如角质上皮细胞没有明显杀伤。
而进一步的动物实验表明,利用该单链抗体构建的CAR-T细胞可以有效清除颅内的EGFRvIII以及EGFR阳性胶母细胞瘤。这些研究结果表明该EGFR/EGFRvIII双靶点的CAR-T细胞有望成为胶母细胞瘤新的治疗手段。
3 可切换的CAR-T细胞治疗胰腺癌效果出色
2018年8月18日,来自悉尼新南威尔士大学(UNSW)和加利福尼亚生物医学研究所(CALIBR)的研究团队带来了一项最新科研进展:新型CAR-T细胞注射到胰腺癌小鼠体内后,能够找到并识别所有的癌细胞,通过表面标记物粘附上它们,随后破坏癌细胞。
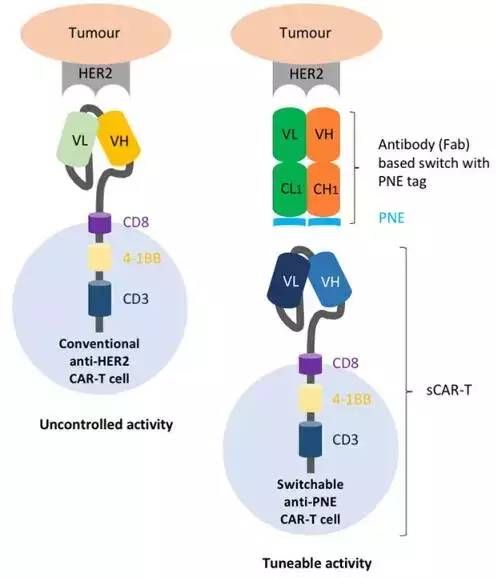
可切换的CAR-T细胞 + 针对HER2的开关控制(图片来源 Gut)
治疗效果非常显著,所有小鼠的癌细胞完全消失,包括已经扩散到肝脏和肺部的癌细胞,这项具有里程碑意义的研究发表在胃肠肝病学行业的顶级学术期刊Gut上。
这款CAR-T疗法将癌症靶标识别和随后的癌细胞杀伤分成了两个独立的过程。而且还首次引入了一项新技术,使CAR-T细胞的活性由肿瘤抗原特异性重组基于Fab的“开关”的剂量控制,可提供完全可控的免疫反应,以克服临床转化上的安全障碍。
4 三靶点CAR-T治疗胰腺癌
2018年6月,来自贝勒医学院的细胞和基因治疗中心的研究团队发表在《Cancer Discovery》期刊上的一项研究表明:其开发的靶向三种抗原(PSCA、TGF和IL4)的新型CAR(即SmarT-细胞)。在临床前研究的测试中,表现出了增强的抗肿瘤活性和选择性,而且没有副作用。
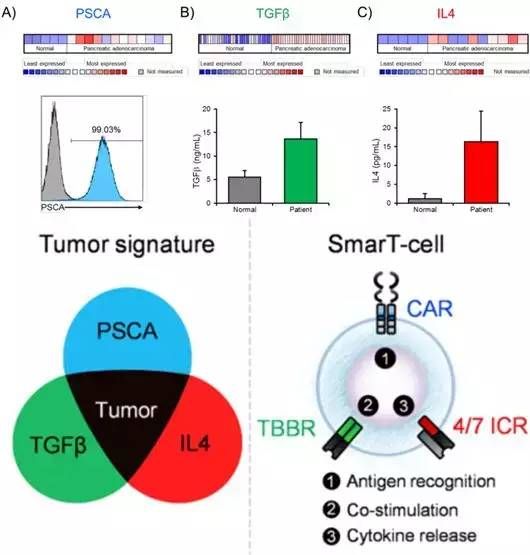
PSCA、TGF和IL4在胰腺肿瘤部位过表达,经设计对胰腺肿瘤的独特特征应答的SmarT-细胞的图示(图片来源 cancerdiscovery)
研究负责人表示,这项研究证明了重编程T细胞识别多个肿瘤表达的标记而非单个抗原标记物的可行性,从而使其修饰的细胞特异性靶向恶性组织,利用先进的基因工程方法,其团队设计的合成受体增强了细胞输注的有效性和安全性,这是CAR T细胞治疗成功的关键因素
5 消除多种实体瘤并预防复发的超级CAR-T
2018年3月,发表在顶级学术期刊《Nature Biotechnology》上的一项重磅研究表明:
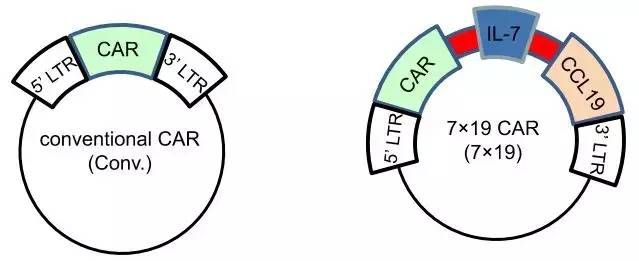
左图表示正常的表达CAR的质粒,右图表示CAR、IL-7、CCL19共表达质粒(图片来源 nature)
日本科学家Koji Tamada(玉田耕治)教授领导的研究团队通过将IL-7以及CCL19基因转入CAR-T细胞制备出了能够有效杀伤肿瘤的“超级CAR-T细胞(7×19 CAR-T)”。
相比较于常规的CAR-T细胞疗法,新一代CAR-T的抗肿瘤效果提高了至少4倍,能够让荷瘤小鼠几乎100%生存。另外,在消除实体瘤100天之后,再次接种癌细胞,也无法形成肿瘤。
临床试验阶段
1 科济生物公布CAR-Claudin 18.2 T细胞治疗胃癌胰腺癌临床数据
2018年9月,在美国波士顿举行的CAR-TCR 峰会上,科济生物公布了其在研CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据。

接受治疗的12名患者中,8名患者经历了不同程度肿瘤消退。特别是在一个经过改良的治疗亚组中,按照 RECIST 1.1 标准,6名患者有5名达到客观缓解(其中1名待确认客观缓解),另外1名达到完全缓解。
2 优瑞科T细胞疗法治疗实体瘤试验结果积极
2018年9月,在美国波士顿举行的CAR-TCR 峰会上,优瑞科生物技术公司发布了针对甲胎蛋白阳性晚期肝细胞肝癌(一种最普遍的肝癌)患者的ET140202 ARTEMISTM T细胞免疫疗法的临床研究的初步安全性和疗效数据。
这一首次用于人体的验证性临床研究在中国西安交通大学第一附属医院开展。初步研究结果表明ET140202 T细胞免疫疗法没有观察到任何细胞因子释放综合症(CRS)以及药物相关的神经毒性,显示了良好的安全性。已经接受治疗的六位受试者中,有三位达到肿瘤消退。其中一名通过静脉输注用药的晚期患者治疗后观察到肿瘤完全消退。
3 全球首例神经母细胞瘤患者完成CAR-NKT细胞治疗
2018年9月,Cell Medica宣布全球首例儿童神经母细胞瘤患者已经成功接受了该公司在研的自体CAR-NKT疗法CMD-501,同时这也是工程化NKT细胞疗法第一次应用于人体。

CMD-501(GD2-CAR NKT):通过对患者自身的NKT细胞(一种特殊类型的先天淋巴细胞,共享T细胞和NK细胞的特性)进行基因工程改造,使其靶向GD2(一种几乎在所有神经母细胞瘤细胞表面均有表达的分子),结合基因工程嵌合抗原受体(CARs)和IL-15细胞因子的分泌,在免疫抑制肿瘤微环境下维持治疗细胞的活性。
临床前研究中已经显示,这种工程化设计可以增加CAR-NKT细胞的持久性并改善它们在免疫抑制性肿瘤微环境中的有效性。
4 西雅图儿童医院启动创新CAR-T治疗实体瘤一期临床
2018年8月,针对复发或难治性非中枢神经系统表达EGFR蛋白的儿童和年轻人实体瘤患者,西雅图儿童医院宣布开启了一项创新CAR-T临床试验(NCT03618381),代号为“STRIvE-01”。

在这项试验中,CAR-T细胞将靶向在大多数儿童肉瘤、肾癌和神经母细胞瘤中表达的EGFR蛋白。为了让CAR-T细胞顺利进入肿瘤微环境,同时确保其能够在那里维持活性、正常扩增且长期存活。研究人员使用EGFR806抗体对CAR- T细胞进行武装,希望有选择地发现并摧毁表达EGFR的实体肿瘤细胞,并限制其对正常组织的毒性。
STRIvE-01试验包括两个序贯治疗组:其中第一个治疗组将接受EGFR806 CAR-T细胞疗法,以评估这种疗法的毒性并确定最大耐受剂量。第一个治疗组结束后,参加第二治疗组的患者会接受同时靶向EGFR和CD19的CAR-T细胞疗法。其中CD19是在B淋巴细胞表面表达的蛋白。
研究人员这样设计,正是希望CD19靶点能够让CAR-T细胞不断与血液中的B淋巴细胞相互作用,以促进靶向EGFR的CAR-T细胞的扩增和持续性。
5 MSKCC开发的CAR-T一期临床彰显治疗实体瘤潜力
2018年5月,在芝加哥举办的第21届美国基因与细胞治疗年会(ASGCT)上,来自MSKCC的Prasad Adusumilli博士介绍了CAR-T(靶向间皮素MSLN)治疗间皮瘤的I期临床试验的早期结果,这种难以治疗的癌症通常会影响肺周围的胸膜组织。

研究人员使用第二代CD28共刺激MSLN CAR和Icaspase-9安全基因(IcasM28z),启动了I期临床试验(NCT02414269),以确定其治疗安全性以及胸腔内给予CAR-T细胞的最大耐受剂量。
临床结果显示:12例MPD(恶性胸膜疾病)患者(包括10例 MPM,1例肺癌,1例乳腺癌),其中一名在CAR-T细胞输注后6周成功接受了根治性手术切除。6名患者(第1至31周)的外周血中检测到了CAR-T细胞。T细胞持续存在与血清SMRP水平下降(与治疗前> 50%相比)以及成像研究(5例患者)肿瘤消退的证据。
7名患者接受了抗PD-1检查点抑制剂治疗(Keytruda),治疗方案结束后,患者没有经历毒性反应。其中一名MPM患者的PET扫描显示完全缓解,该患者在CAR -T细胞输注后8个月保持临床上的良好状态,在31周时具有外周血和组织中CAR-T细胞持续存在的证据。
6 新一代CART治疗复发/难治性IV期肾细胞癌
2018年1月,上海普珩生物技术有限公司宣布,用于治疗转移性肾细胞癌的两个新型肿瘤酸性微环境激活CAR-T产品临床试验信息正式公布在clinicaltrials.gov上(NCT03393936)。
该项题为“CCT301 CAR-T治疗成人复发或难治性IV期转移性肾细胞癌的安全性和有效性”的临床试验是基于肿瘤酸性微环境激活技术平台开发的产品全球开展的首个人体临床试验,目前该临床试验已经在上海中山医院及中山医院南院——上海公共卫生临床中心开始临床招募和入组工作。
综上所述,我们相信,随着研究人员对肿瘤微环境以及其他影响CAR-T抗肿瘤作用的因素的研究越来越透彻,新型细胞疗法在实体瘤治疗领域一定会得到长足发展。而更好地了解CAR-T细胞持续的重要性也是未来研究的一个重点。毕竟,治疗的目的是为恶性肿瘤患者提供持久的、理想的永久性缓解。




{replyUser1} 回复 {replyUser2}:{content}