国家生物医学分析中心揭示NLRP3磷酸化修饰与炎症小体通路激活的调控机制
9月21日,Molecular Cell在线发表了国家生物医学分析中心李涛研究员和周涛研究员合作的题为“NLRP3 phosphorylation is an essential priming event for inflammasome activation”的最新研究成果。该文报道了磷酸化是NLRP3炎症小体预激活阶段(Priming)的关键分子事件,阐明了磷酸化修饰在NLRP3炎症小体通路激活中的重要调控作用,丰富了对固有免疫应答机制的认识。
 论文解读:
论文解读:
固有免疫系统是机体抵御病原体入侵的第一道防线。宿主针对病原体的快速检测,主要依赖于模式识别受体。NLRP3是NLR模式识别受体家族中的重要成员,能够识别病原体及组织损伤相关的分子模式。NLRP3激活后与凋亡相关斑点样蛋白(ASC)、半胱天冬氨酸酶-1(Caspase-1)等蛋白质分子组装形成多聚复合物——炎症小体,促进白介素-1等炎性因子的分泌及细胞焦亡的发生,诱发剧烈炎症反应。NLRP3炎症小体异常激活与肿瘤、自身免疫疾病等多种重大疾病密切相关。因此,深入研究NLRP3炎症小体的激活过程,阐明炎症小体复合物中关键分子的调控机制,是发现治疗上述疾病新靶标的重要途径。
已有研究表明,NLRP3炎症小体激活受到两级信号调控,第一级信号为预激活(Priming),第二级信号为组装(Assembly)。目前关于第二级信号的调控机制已有较多报道,但第一级信号如何调控炎症小体激活仍不清楚。
在该项研究中,研究人员首先采用质谱技术鉴定到NLRP3蛋白质第194位丝氨酸(Ser194)的磷酸化修饰,进一步发现该位点磷酸化修饰特异发生于炎症小体激活的第一级信号(Priming)阶段。通过炎症小体体外重建、磷酸化位点突变knock-in小鼠构建以及生物信息学分析等一系列体内体外实验手段,研究者深入揭示了JNK1是NLRP3 Ser194磷酸化的激酶,该磷酸化修饰介导了NLRP3去泛素化及寡聚化,进而促进NLRP3炎症小体激活(下图)。
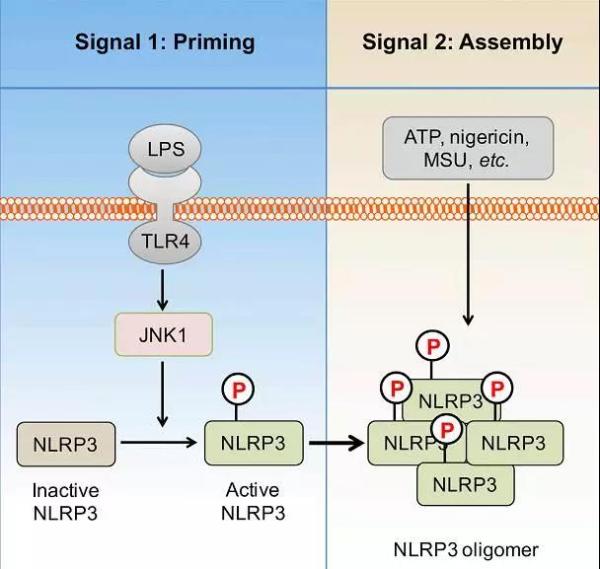 同时,研究还发现,封闭该位点的磷酸化可以抑制疾病相关NLRP3突变体的自激活,为NLRP3介导自身免疫综合征等疾病的治疗提供了潜在靶点。
同时,研究还发现,封闭该位点的磷酸化可以抑制疾病相关NLRP3突变体的自激活,为NLRP3介导自身免疫综合征等疾病的治疗提供了潜在靶点。
据悉,国家生物医学分析中心的李涛研究员和周涛研究员为本文通讯作者,宋楠博士为第一作者。研究工作获得国家科技重大专项、国家高技术研究发展计划(863)、国家自然科学基金以及北京市科委前沿技术等项目的资助。


{replyUser1} 回复 {replyUser2}:{content}