研究发现微环境中衰老细胞导致临床治疗抵抗的新机制
10月17日,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院上海生命科学研究院(营养与健康研究院)孙宇研究组题为Targeting SPINK1 in the damaged tumour microenvironment alleviates therapeutic resistance 的最新研究成果。该论文发现临床治疗过程中微环境内出现大量因药物损伤而衰老的细胞群,后者成为持续性产生多种促炎因子的活跃源泉,其中一种名为SPINK1的可溶蛋白通过基质细胞高度合成与胞外释放,源源不断进入受损的微环境空间,改变残存癌细胞多种表型并促使其获得多药耐药性,从而导致临床治疗抵抗。同时,大数据分析表明,循环血液中SPINK1蛋白含量的动态变化,同患者生存密切相关,可以作为将来临床预后与疗效评价的精确指标,为提高临床医学抗癌成功率提供了重要靶标和判断依据。
尽管癌症的特效药物和治疗手段日新月异,但癌症仍然是人类当前主要的死亡原因。肿瘤的发生、进展及转移受到癌细胞自身的强烈影响,但更与肿瘤微环境的相互作用密不可分。大多数抗癌疗法都针对癌细胞自身,而忽略了其周围的局部微环境。作为肿瘤微环境的关键组成部分,基质组织对于癌症有着重要意义。近年研究表明微环境是肿瘤耐药等现象的 “帮凶”,俨然成为疾病预防和治疗的关键因素之一。然而,微环境在临床中究竟是如何扮演这些角色的呢?
在这一新研究中,博士研究生陈斐等人首先根据人源全转录组数据深度分析,发现微环境中的基质细胞在经过放化疗等手段处理之后并不直接出现类似癌细胞的典型凋亡特征,而是随即进入另外一种状态,即细胞衰老。伴随这一变化的,则是以大量生成炎性因子为主要特点的衰老相关分泌表型(senescence-associated secretory phenotype, SASP)。尽管人们对于SASP表达谱中大多数因子的生物功能和病理影响已经清楚,但个别分子在肿瘤进展中的意义仍属未知。其中表达幅度较为突出的SPINK1 (serine protease inhibitor Kazal-type I,又名PSTI或TATI)是一种丝氨酸肽酶抑制因子。过往研究表明,SPINK1在人体中主要是抑制胰腺蛋白酶原的成熟性激活和随后酶活性的释放,而该因子的突变可以造成慢性胰腺炎,并向胰腺癌过度。
在前列腺癌患者中,SPINK1的表达与ETS gene fusion为相互排斥事件。SPINK1在癌细胞中的表达水平同患者临床预后呈显著负相关,而大数据研究证实SPINK1作为outlier的表达可以作为前列腺切除手术之后患者biochemical recurrence的一个独立预测因子。尽管十年前这一现象已被美国University of Michigan的Arul Chinnaiyan的研究小组发现,该实验室后来也进行了一系列的深入研究,但仍然集中于前列腺癌上皮细胞,来自前列腺微环境的影响并未考虑在内。
鉴于上述实验结果,孙宇组的研究数据表明大多数造成DNA damage的药物包括电离辐射本身均能诱导SPINK1在人源基质细胞中大幅上调,而同组织来源的癌细胞则无显著变化。这种来源于组织微环境非癌细胞的SPINK1,究竟有何重要意义?研究人员随后对常见的实体瘤进行了分析。在一个前列腺癌临床队列中,化疗后阶段的患者体内出现了明显的SPINK1蛋白,这与化疗前时期形成鲜明对比。更为重要的在于,SPINK1蛋白在病灶中的表达,集中体现于腺体周边的基质组织,而非人们平时最关注的腺体中的上皮细胞。根据基质细胞中其它蛋白表达水平或者活化程度进行类似的病理分级之后,结果显示SPINK1的表达同已知的SASP表型的两个典型标记物IL-8和WNT16B的表达状态呈现密切关联。同时,SPINK1在基质细胞中的表达水平越高,患者的临床预后越差,生存期越短,暗示SPINK1具有突出的病理意义。
相比于原代基质细胞CM,SPINK1阳性基质CM可以深刻改变癌细胞的表达谱。PC3和DU145这两个细胞系中出现protein-coding,lncRNA,miRNA,miscRNA和pseudogene等成分的普遍变化。在PC3和DU145之间差异表达的基因有465个;在对这些分子进行系统分析之后发现,GO变化最显著的是immune response, signal transduction和cellcommunication等方面。癌细胞在基质细胞来源的SPINK1作用下除了出现EMT和CSC development表型切换的同时,更呈现出angiogenesis类似的一系列相关变化,包括CD31/CD34等分子在转录本和蛋白水平均出现显著上调。Expression site生信分析和体外tube formation assay检测均证实了癌细胞这一血管生成的惊人趋势。
在前临床实验中,研究人员使用了SPINK1的单克隆抗体,以及已被美国FDA批准的、临床中用于阻断EGFR的西妥昔单抗Cetuximab。有趣的是,化疗/SPINK1单抗联用造成的治疗效果,甚至要高于化疗/Cetuximab联合的效果。这无论在小鼠肿瘤终端体积还是体内生物荧光信号的检测上,都获得了一致性数据。更重要的是,对肿瘤切片进行组化分析时,他们发现化疗/SPINK1单抗联用可以造成比化疗/Cetuximab联用更高的癌细胞凋亡率,暗示微环境中的SPINK1在前列腺癌细胞表面可能不止EGFR这一个受体。
随后的临床数据表明,SPINK1可以在多种癌型化疗后阶段的患者血浆中被检测到,其水平显著高于化疗前时期。此外,SPINK1同IL-8在同一批患者一对一的分析中呈现出一定程度的关联。Immunoblot显示出这两个外泌因子在患者血浆中几乎同时出现,且化疗后阶段同化疗前时期之间形成鲜明对比。在原位肿瘤、外周血液之间的定量分析,进一步揭示了SPINK1和IL-8之间存在密切关联,暗示局部微环境中的这些SASP因子最终要进入循环系统并可以作为临床治疗过程中评估癌症患者体内SASP发生发展的新型标记物。
相比于近年国际上有关癌细胞耐药性内在机制的一系列报道,这项研究深刻揭示了肿瘤微环境中的基质细胞在化疗过程中可以迅速进入衰老阶段并生成与释放大量的SASP因子,其中的SPINK1可以激活疗后阶段残存下来的癌细胞,使其获得对于临床药物的抵抗。这种获得性耐药,正是造成日后肿瘤复发和转移的生物学基础,也成为患者在临床中出现多药耐药等现象的重要病理根源。
该研究得到中国科技部、基金委、中科院等相关单位的资助。
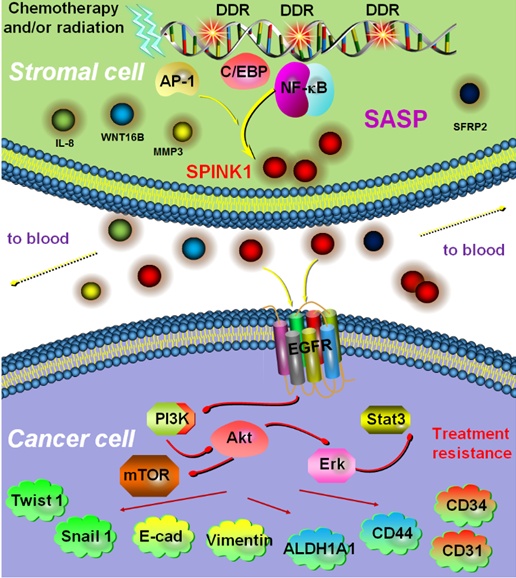 肿瘤微环境中衰老细胞衍生的SASP因子SPINK1激活残存癌细胞、导致其获得性耐药发生发展的分子机制
肿瘤微环境中衰老细胞衍生的SASP因子SPINK1激活残存癌细胞、导致其获得性耐药发生发展的分子机制
相关论文:
Targeting SPINK1 in the damaged tumour microenvironment alleviates therapeutic resistance
来源:中国科学院
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}