论文解读:大脑中的哪些神经回路与奖赏和厌恶刺激有关
美国斯坦福大学的研究人员用一种巧妙方法鉴定出大脑中与奖赏和厌恶刺激相关的神经回路。这项在小鼠中开展的研究可能对于解决人类的多种精神疾病,包括焦虑症、失眠和抑郁及其他神经失调性疾病具有极为重要的启迪意义。
这篇题为“Parallel circuits from the bed nuclei of stria terminalis to the lateral hypothalamus drive opposing emotional states”的论文发表在《Nature Neuroscience》杂志8月刊上。第一作者为斯坦福大学的William Giardino。
实验背景
对厌恶或奖赏刺激做出适当的反应,以便快速响应环境的变化,这对生存而言至关重要。用于调节情绪的皮质下神经系统在进化上的保守性也提示其对于生存的重要意义。
趋近和回避行为的背后机制到底是什么?该研究聚焦于负责调节激励情感因素的下丘脑外侧区(LH)的复杂连结。外侧下丘脑神经元由多种不同类型细胞混合组成,而后核LH神经元表达一种神经肽——下丘脑泌素(HCRT;也被称为食欲素/orexin)——这种下丘脑泌素HCRT对动机性行为尤其重要。HCRT-LH神经元可接收来自大脑回路的信号,通过HCRT受体信号通路实现行为状态的转变,被认为可促进消极的和积极的两种情绪状态。但要分析HCRT-LH神经元活性和情绪性行为之间的精确机制,依然困难重重。
我们知道大脑杏仁核区对于恐惧、奖励和焦虑等情绪处理来说是至关重要的大脑区域。
杏仁核外延的终纹床核(BNST)是连接杏仁核与下丘脑的区域。在这项新研究中,研究人员证实了下丘脑外侧区LH神经元的输入(input)正是源自于终纹床核(BNST)的密集突触输入,可能由此控制响应情绪刺激产生的复杂行为反应,并且鉴别了终纹床核(BNST)和外侧下丘脑(LH)之间的、与趋近/回避行为相关的两组不重叠的神经通路。
实验看点
本文设计了一系列巧妙的实验方案,得以在活体小鼠中精确解析终纹床核(BNST)到外侧下丘脑(LH)之间的脑回路,值得参考。
1. 构建模式小鼠。神经系统的功能研究需要在活体进行,构建模式小鼠使得研究人员能够观察遗传定义下的可自由移动的活体小鼠在特定刺激下的响应与行为,从多个角度不同方位进行实验分析验证。
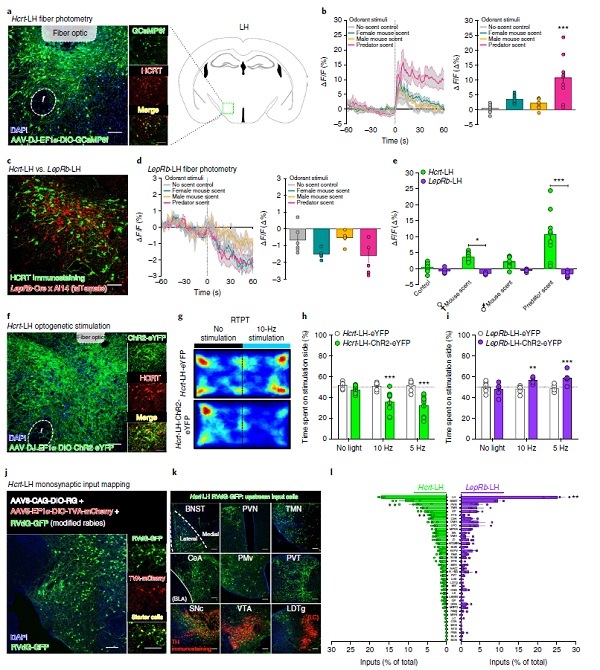
研究人员委托赛业生物(Cyagen)制备了Hcrt-IRES-Cre小鼠,这是一种Cre重组酶特异性表达小鼠,在有下丘脑泌素Hcrt基因表达的组织/细胞就有Cre重组酶的表达,在外侧下丘脑LH内部给予Cre诱导型荧光标记的腺相关病毒(AAV),>90%表达病毒的神经元是HCRT+,表明该模式小鼠Hcrt-LH区域具有特异性重组酶活性。
2. 不同的外界信号刺激会对LH神经元产生什么影响?
以基于用GCaMP6(基于绿色荧光蛋白GFP作为 Ca2+的指示剂)转染小鼠体内Hcrt-LH神经元,在外侧下丘脑LH上方植入光纤,以此来记录监测在不同(厌恶或奖赏)刺激条件下内源性钙信号(Ca2+)的变化。将植入小鼠安置在可进行自由移动实验的环境中。
实验表明:相对于无刺激的本底信号,环境中给予任何一种刺激——即使是无味的生理盐水——也会引起Hcrt-LH Ca2+活性升高,荧光活性提高。相比对照刺激,给予捕食者气味(三甲基-3-噻唑啉(狐狸尿))刺激时Hcrt-LH GCaMP6 荧光活性显著升高。数据分析表明这些神经元对负面情绪的刺激特别敏感。
用同上的方法分析表达瘦素受体标记的LepRb-LH(leptin receptor)神经元 (LepRb-Cre)。LepRb-LH神经元与前面的Hcrt-LH神经元并不重叠,先前研究已知LepRb-LH神经元可通过Hcrt-LH神经元的GABA能抑制(GABAergic inhibition)来调节神经内分泌和应激反应行为。
植入光纤监测 GCaMP6+ LepRb-LH 神经元结果显示,所有刺激均降低荧光信号,特别是捕食者气味明显降低LepRb-LH神经元的 Ca2+活性,与前面的Hcrt-LH神经元截然不同。
3. Hcrt-LH在奖赏和厌恶刺激下都会激活,这个说法是真的吗?生理刺激LepRb-LH神经元和Hcrt-LH神经元会有怎样的结果?
继续重复上述的实验设计思路:用增强的黄色荧光蛋白标记的光敏通道蛋白(ChR2-eYFP;或仅eYFP对照病毒)转染小鼠体内Hcrt-LH神经元,结果>90%的ChR2-eYFP+细胞为表达HCRT+ 细胞。在小鼠LH上方植入光纤并给予不同光刺激(将植入小鼠安置在可进行自由移动实验的环境中),观察小鼠在实时位置趋向实验 (the real-time place test,RTPT)中的行为偏向。
结果表明,相比对照组,Hcrt-LH-ChR2 小鼠回避光刺激(缩短在光刺激侧的停留时间,而进入次数没有变化/提示与位置无关)提示光刺激使Hcrt-LH神经元产生了厌恶、消极的情绪状态。用Hcrt受体拮抗剂可阻断这一趋避行为。而KOR阻断剂不能改变趋避行为。
相反的,光刺激LepRb-LH-ChR2小鼠则表现为趋近偏好(延长停留在光刺激侧时间,而进入次数没有变化/与位置无关)表明LepRb-LH神经元激活是趋近偏好的。这两组神经元在刺激诱导下表现出各自独特的Ca2+离子活性特征,产生了效价效应相反的趋近和回避行为。
4. 接着来,证实LH输入源为BNST。杏仁核外延的终纹床核(BNST)是连接杏仁核与下丘脑的区域。
为了探索Hcrt-LH神经元负面情绪状态的神经回路,作者又想了个办法尝试找出驱动调控Hcrt-LH神经元的上游网络。用糖蛋白缺失的狂犬病病毒(RVdG-GFP)单突触追踪策略,全脑分析确定了来自前脑,下丘脑,杏仁核,中脑和脑干的主要传入输入,最后定量分析显示终纹床核BNST是Hcrt-LH神经元主要输入源(除LH来源外的),也是LepRb-LH神经元的主要输入来源。与LebRb-LH相比,Hcrt-LH神经元从LH本身接收输入较少,来自室旁下丘脑(PVN)和腹侧被盖区域(VTA)的输入较多。这些数据表明多种LH细胞类型共享一个主要输入源终纹床核(BNST),但也从其他来源接收差异丰富的输入。
5. 再接着溯源,具体是BNST的哪一部分负责输入信号给这两组LH神经元?
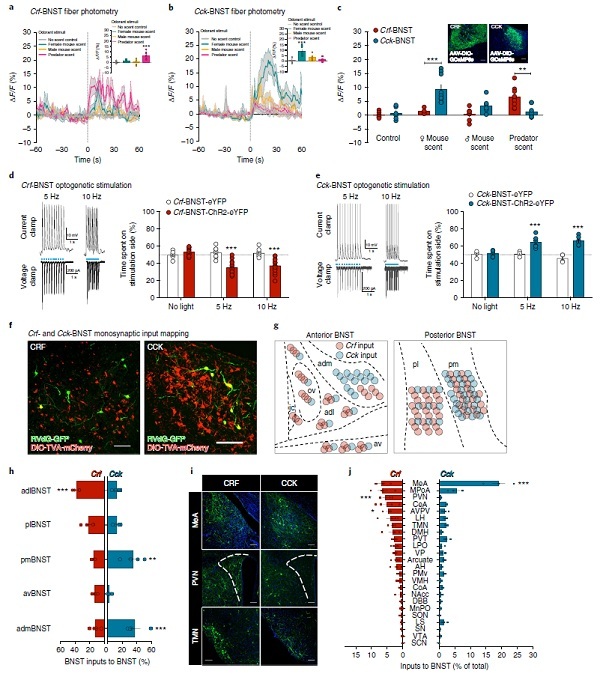
作者又鉴定出与Hcrt-LH神经元直接突触接触的BNST神经元。通过切片分析LepRb-Cre小鼠和Hcrt-Cre小鼠中的RVdG-GFP +细胞集中于BNST的不同区域,Hcrt-Cre更集中于侧向BNST。选择Crf(促肾上腺皮质激素释放因子)作为侧向BNST标记(Crf-BNST神经元可调节焦虑,恐惧和成瘾相关行为)。Cck(胆囊收缩素)作为内侧BNST神经元标记。Hcrt-LH小鼠中的RVdG-GFP + BNST神经元包含更多的Crf-BNST群体(相比Cck-BNST),Hcrt-LH神经元从Crf +神经元接受更多输入(约60%的Hcrt-LH神经元接受来自Crf-BNST神经元的直接输入,而只有约12.5%的Hcrt-LH神经元接受来自Cck-BNST神经元的直接输入)。
6. 那么Crf+ BNST 神经元和Cck+ BNST 神经元的生理学和行为学表现会有什么不一样呢?
构建Crf-Cre和Cck-Cre小鼠继续上述设计来鉴别BNST-LH的神经回路。在Crf-Cre和Cck-Cre小鼠的BNST中表达ChR2-eYFP(或仅eYFP),并在LH上植入光纤。Crf-BNST-ChR2光刺激产生了对刺激侧的逃避,表明Crf-BNST激活是厌恶性的(回避)。 Cck-BNST-ChR2光刺激产生了对刺激配对侧的偏好,表明Cck-BNST激活是奖励性的(趋近)。BNST→LH光刺激的 实时位置趋向实验(RTPT)显示Crf-BNST→LH-ChR2小鼠的回避行为;光刺激Cck-BNST→LH-ChR2小鼠产生偏好/趋近行为,表明遗传定义的BNST→LH途径可产生相反的情绪状态。同样的,Crf-BNST- GCaMP6 荧光活性在捕食者气味刺激下(有害)显著升高(相对其他刺激),而Cck-BNST- GCaMP6荧光活性则在雌性小鼠尿刺激下(有利)显著升高,阻断Cck(而不是Crf)能降低这种趋向。通过实验作者还证实了这两类神经元不重叠。
实验结果:确定了两个空间隔离的GABA能BNST亚群,它们(i)表达不同的神经肽标志物,(ii)差异支配所定义的LH亚群,(iii)表现出不同形式的显着刺激诱导Ca2+活性,(iv)接收来自不同上游网络的传入输入,以及(v)驱动相反的趋近和回避行为。
研究人员认为,这些数据提供了一个先进的模型,说明平行的终纹床核至外侧下丘脑回路如何通过特定的神经元亚群来推动不同的情绪状态。这种实验模型为难以研究的神经回路提供了一种值得参考的设计。这项研究有望为精神疾病中LH回路失调提供思路,未来的研究将为开发改进的治疗方法提供信息。


{replyUser1} 回复 {replyUser2}:{content}