过半患者疼痛减轻50%以上 创新止痛药3期结果喜人
日前,辉瑞(Pfizer)和礼来(Eli Lilly)在美国风湿病学会/美国风湿病卫生专业人员协会(ACR/ARHP)2018年会上,宣布了在研止痛药tanezumab,在治疗骨性关节炎(OA)的3期试验的完整数据。本次新公布的数据显示,在接受治疗第16周,超过一半患者的疼痛程度获得了50%及以上的减轻,且tanezumab安全性良好。

OA是最常见的关节炎类型,由于骨骼两端具有保护功能的软骨磨损而导致。患者最主要的症状之一是慢性疼痛,可能在关节运动时或运动后发生,同时也会限制患者的运动能力。在美国,OA影响了大约2000万人。到目前为止,OA患者仍旧普遍使用阿片类药物进行镇痛,但由于近年来阿片类药物的滥用危机,患者们急需一款安全的新型疗法帮助他们减轻OA带来的疼痛。
Tanezumab是一款在研的人源NGF单克隆抗体,也是首个得到FDA快速通道资格的NGF抑制剂,可以选择性结合并抑制神经生长因子(NGF)的功能。在人体出现因受伤、炎症引起的疼痛或慢性疼痛时,NGF的水平也会相应上升。因此,通过选择性抑制NGF,tanezumab可能有助于阻断肌肉、皮肤和器官产生的疼痛信号进入脊髓和大脑。由于tanezumab这一新作用机制与阿片类药物和包括非甾体类抗炎药(NSAIDs)在内的其它镇痛药完全不同,在至今为止的试验中从未出现过任何成瘾、滥用或依赖的风险。Tanezumab的研究目前主要集中于对OA疼痛、重度慢性腰疼(CLBP)及由于癌症骨转移引起的疼痛这三类疼痛的治疗。
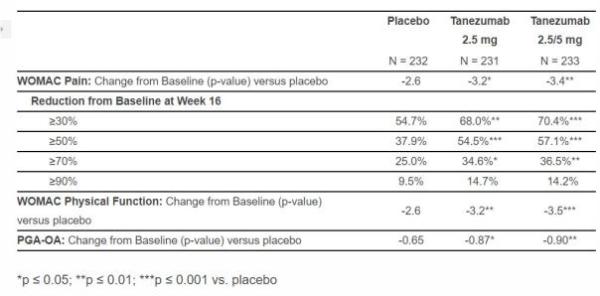
A4091056 3期试验结果摘要
本次公布数据的3期试验A4091056是一项长达16周的随机双盲多中心安慰对照试验,共包含698名患者。该试验评估了在第16周相对于基线的3个共同主要疗效终点,使用WOMAC(Western Ontario and McMaster Universities Osteoarthritis Index)疼痛量表和医师全面评估-OA(PGA-OA)评分对患者的疼痛剧烈程度及运动功能进行了评分。
结果显示,该试验达到了全部3项共同终点,tanezumab显示出了良好的疗效、安全性与耐受性。值得一提的是,关于tanezumab的3期试验项目将在全球范围开展六项试验,共包含约七千名患有OA疼痛、CLBP及由于癌症骨转移引起疼痛的患者,评估tanezumab的疗效及安全性。其它3期试验的数据将于2019年上半年开始逐渐公布。
“本次公布的数据具有重大的意义,尤其是参与试验的患者均受中度至重度疼痛的折磨,且无法从包括阿片类药物及NSAIDs在内的其他疗法选项中获得适当的疼痛减轻,”辉瑞全球产品开发部tanezumab开发团队负责人Ken Verburg博士说:“我们的目标是使tanezumab成为潜在的非阿片类药物疗法选择,为深受OA疼痛折磨的患者们带来希望。”
礼来高级副总裁兼礼来生物医药公司总裁Christi Shaw女士补充道:“本次公布的3期试验完整数据证明了tanezumab具有极高的潜力,我们期待进一步推进研发进程,于明年公布更多的数据。”
我们期待辉瑞和礼来可以继续推进tanezumab的研发进程,早日完善该药,为患者们带来福音。
参考资料:
[1] Complete Results from First Study in Ongoing Phase 3 Program for Tanezumab Demonstrated Significant Improvement in Pain and Function in Osteoarthritis Patients. Retrieved October 24, 2018, from https://www.businesswire.com/news/home/20181023005394/en/
[2] Eli Lilly and Pfizer’s Osteoarthritis Drug Dazzles in Phase III. Retrieved October 24, 2018, from https://www.biospace.com/article/eli-lilly-and-pfizer-s-osteoarthritis-drug-dazzle-in-phase-iii/
[3] 辉瑞/礼来骨性关节炎在研新药达到所有3期终点. Retrieved October 24, 2018, from https://mp.weixin.qq.com/s/KHlaT3mspcPUmXILhnBEXA
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}