Nature子刊:癌细胞为啥对治疗产生抗药性?这项研究有望带来治疗新思路
基于DNA损伤机制的化疗和放疗是癌症最主要的治疗方式之一。然而,癌症细胞的抗药性会严重影响放化疗的效果。今日,《自然》杂志子刊《Nature Structural and Molecular Biology》在线发表了加州大学圣地亚哥分校(UCSD)李蔓青博士和Michael David教授作为共同通讯作者的一项最新研究,揭示了癌症细胞获得放化疗抗药性的一个全新分子机制,并提出了一个有效的针对性药物研发方案。
 1998年,科学家们发现了一个新的基因家族。因为该基因家族被研究的第一个基因成员的过量表达会阻止细胞分裂,这个基因家族被命名为Schlafen(德语“沉睡”之意)。然而,该基因家族成员的生理和细胞功能却长期未知。
1998年,科学家们发现了一个新的基因家族。因为该基因家族被研究的第一个基因成员的过量表达会阻止细胞分裂,这个基因家族被命名为Schlafen(德语“沉睡”之意)。然而,该基因家族成员的生理和细胞功能却长期未知。
2012年,李蔓青博士和Michael David教授首次在《自然》杂志报道,人类Schlafen 11基因编码的蛋白通过对转运核糖核酸(transfer RNA,tRNA)的调节,抑制人类免疫缺陷病毒HIV病毒蛋白的合成,从而抑制HIV病毒的繁殖。有趣的是在同年,两项独立研究发现,Schlafen 11基因的表达是决定癌细胞化疗敏感性的首要因素,表明这一基因对于多种疾病有着潜在的作用。

在今日发表的研究中,李蔓青博士和Michael David教授进一步阐明了Schlafen 11基因如何能影响癌症化疗。类似于对HIV病毒蛋白合成的抑制,该基因编码的SLFN11蛋白在激活时,会导致特定tRNA的降解,从而抑制对DNA损伤修复至关重要的相关蛋白的表达。在正常表达SLFN11蛋白的细胞中,严重的DNA损伤会高度激活SLFN11蛋白的功能,抑制损伤DNA的修复,从而通过细胞凋亡清除受损细胞,避免在大规模DNA修复的过程中引入DNA变异和细胞癌化。然而在大量的癌症细胞中,Schlafen 11基因的蛋白表达被沉默,使得这些癌细胞拥有比正常细胞更强的DNA损伤修复能力,从而获得对放化疗的抗药性。
“我们发现,表达SLFN11蛋白的癌症细胞受到导致DNA损伤的药物处理时,ATR和ATM的蛋白表达会被强烈抑制,这就是这些癌症细胞死亡的根本原因,”Michael David教授说:“而在那些不表达SLFN11蛋白的癌症细胞里,你就看不到对ATR和ATM的蛋白表达的抑制,癌细胞就会活下来。”
对SLFN11蛋白功能分子机制的进一步研究表明,SLFN11蛋白功能的激活引起某些特定tRNA的降解,包括所有亮氨酸(Leucine)和丝氨酸(Serine)的tRNA。和其余的大多数tRNA的三叶苜蓿草结构不同,在原有的可变环结构(variable loop)的位置,这些亮氨酸(Leucine)和丝氨酸(Serine)的tRNA拥有一个更长的可变柄环结构(variable stem-loop),使它们的二级结构看起来更像四叶苜蓿草。“这可能就是SLFN11蛋白识别降解这些特定tRNA的结构特征,”李蔓青博士解释说:“这其中有一个特殊的亮氨酸转运核糖核酸 (Leucine transfer RNA),tRNA-Leu-TAA,它的表达水平非常低,同时它又被在ATR和ATM的蛋白合成中大量使用。这就使得ATR和ATM的蛋白合成对因为SLFN11功能激活而引起的这种亮氨酸转运核糖核酸(tRNA-Leu-TAA)的降解极端敏感。”
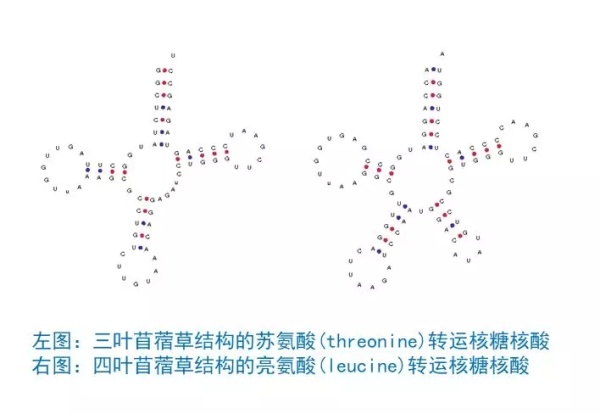
▲tRNA的不同结构或许是SLFN11蛋白的作用关键(图片来源:http://gtrnadb.ucsc.edu/)
更深入的研究发现,绝大多数和DNA损伤修复有关的蛋白的合成都高度依赖于这种稀有的亮氨酸转运核糖核酸(tRNA-Leu-TAA)。李蔓青博士发明了一种使用特殊的反义寡核苷酸(antisense oligonucleotide)来抑制这种亮氨酸转运核糖核酸(tRNA-Leu-TAA)表达的方法,从而抑制这些和DNA损伤修复相关蛋白的合成,达到克服这些癌症细胞对放化疗抗药性的目的。和其他针对单一靶标的药物相比,这种新的治疗途径针对整个DNA损伤修复机制,所以癌症细胞几乎没有产生抗药性的可能。
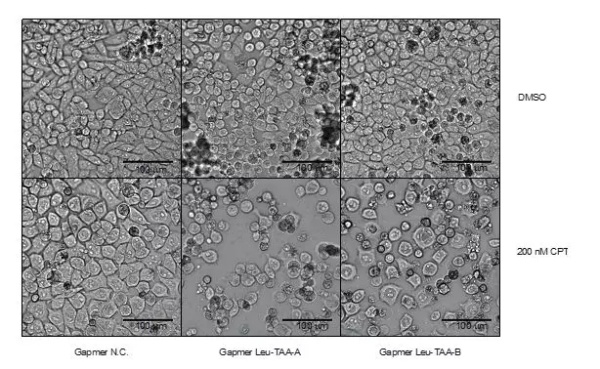
▲在细胞实验中,这一疗法效果良好
在细胞实验中,这一核苷酸疗法取得了优秀的成绩——通过使用特殊的反义寡核苷酸(antisense oligonucleotide)来抑制亮氨酸转运核糖核酸tRNA-Leu-TAA的表达,不表达SLFN11蛋白的胰腺癌细胞对化疗的抗药性也能被克服,进入细胞凋亡。
本项研究的另一位共同作者,加州大学圣地亚哥分校医学院荣誉退休教授,美国文理科学院院士王映真(Jean Y.J. Wang)教授指出,了解癌症细胞在DNA受损的情况下如何避免死亡,有助于研发新的治疗手段来促进放化疗对癌症的治疗效果。“这项研究成果表明可以通过两个途径来促进DNA损伤药物对癌症细胞的杀伤。1)抑制ATR蛋白激酶的活性。2)抑制tRNA。同时,这项研究第一次发现并报道了DNA受损细胞的存活取决于tRNA的调节,对细胞DNA损伤反应的基础研究具有重要的学术意义。”
Michael David教授进一步指出,类似的治疗方法也有很大潜力可以被用于治疗HIV和其他高度依赖这种亮氨酸转运核糖核酸(tRNA-Leu-TAA)进行蛋白合成的病毒,并有效防止抗药病毒株的产生。值得一提的是,目前多种反义寡核苷酸(antisense oligonucleotide)类型的药物已经被美国FDA批准治疗包括脊髓性肌肉萎缩症在内的多种疾病,这一类型的药物其潜力也为人所看好。
参考资料:
1、Li, M. et al. Codon-usage-based inhibition of HIV protein synthesis by human schlafen 11. Nature 491, 125-128, doi:10.1038/nature11433 (2012).
2、Barretina, J. et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature 483, 603-607, doi:10.1038/nature11003 (2012).
3、Zoppoli, G. et al. Putative DNA/RNA helicase Schlafen-11 (SLFN11) sensitizes cancer cells to DNA-damaging agents. Proc Natl Acad Sci U S A 109, 15030-15035, doi:10.1073/pnas.1205943109 (2012).
来源:学术经纬
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}