Keytruda获批一线治疗鳞状非小细胞肺癌
今日,默沙东(MSD)公司宣布,美国FDA批准该公司的重磅免疫疗法Keytruda,与卡铂和紫杉醇联用,作为一线疗法治疗转移性鳞状非小细胞肺癌(NSCLC)。这项批准是抗PD-1疗法第一次获得批准作为一线疗法治疗鳞状NSCLC,而且不需考虑肿瘤的PD-L1表达水平。
肺癌是世界上导致癌症死亡的首要原因之一。每年死于肺癌的患者超过死于结肠癌,乳腺癌和前列腺癌的患者总和。肺癌主要分为小细胞肺癌和NSCLC两种。NSCLC是最常见的肺癌种类,大约占肺癌患者总数的85%。在美国,确诊的肺癌患者的5年生存期约为18%。
Keytruda是默沙东公司开发的重磅抗PD-1 疗法,它能够通过阻断PD-1与PD-L1和PD-L2的结合,激活T淋巴细胞发现和攻击肿瘤细胞。自从问世以来,Keytruda已经获得批准治疗多种类型的癌症,其中包括黑色素瘤,肺癌,头颈癌,经典霍奇金淋巴瘤等等。
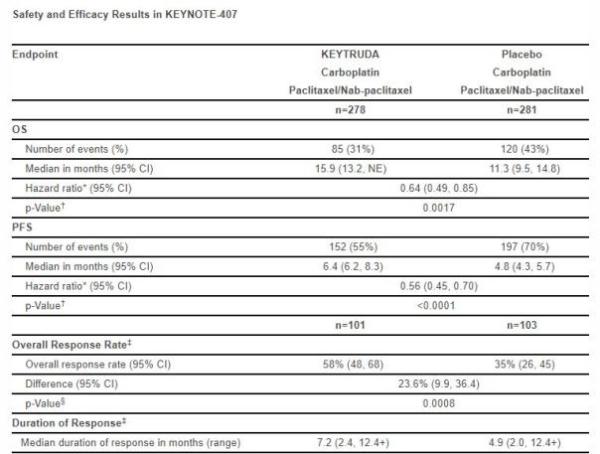
▲KEYNOTE-407试验数据摘要(图片来源:默沙东官网)
这一批准是基于Keytruda在名为KEYNOTE-407的关键性3期临床试验中的表现。在这项随机双盲,含安慰剂对照的多中心试验中,不考虑肿瘤的PD-L1表达水平,Keytruda与化疗结合,与单纯化疗相比,能够显著提高患者的总生存期(OS),将患者死亡风险降低36%(HR=0.64 [95% CI, 0.49, 0.85]; p=0.0017)。同时,患者的无进展生存期(PFS)和客观缓解率(ORR)也得到统计显著改善。
“今日的批准进一步推广了Keytruda的肺癌适应症范围,包括了作为组合疗法治疗鳞状NSCLC患者,这是一种尤其难治的肺癌种类,”默沙东研究实验室总裁Roger M. Perlmutter博士说:“获得FDA批准意味着Keytruda将能够改善更多患者的生存。”
参考资料:
[1] FDA Approves Merck’s KEYTRUDA® (pembrolizumab) in Combination with Carboplatin and Either Paclitaxel or Nab-Paclitaxel for the First-Line Treatment of Patients with Metastatic Squamous Non-Small Cell Lung Cancer (NSCLC). Retrieved October 30, 2018, from https://www.businesswire.com/news/home/20181030006098/en/FDA-Approves-Merck%E2%80%99s-KEYTRUDA%C2%AE-pembrolizumab-Combination-Carboplatin
[2] Keytruda. Retrieved October 30, 2018, from https://www.keytruda.com/
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}