阿片类药物DSUVIA™获批 FDA局长亲自站台回应争议
2018年11月02日,AcelRx Pharmaceuticals一款舒芬太尼舌下片DSUVIA™获FDA批准,该款药物主要用于需阿片类药物控制的成人急性疼痛,药物使用严格限制。
DSUVIA™的获批饱受争议,舒芬太尼已有注射剂获批上市,舌下片获批的必要性在哪里?FDA局长亲自站台,回应DSUVIA™获批争议,本文立足DSUVIA™,并简要总结FDA对未来阿片类药物审评审批的考量。
一、DSUVIA™|舒芬太尼舌下片
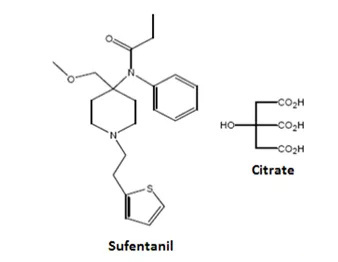
舒芬太尼是一种麻醉性镇痛药,市场上产品均为注射给药,相比注射剂,AcelRx Pharmaceuticals开发的这款舌下片剂使用更为简便,更适用于肥胖、烧伤等类无法吞咽或不适合静脉给药患者。
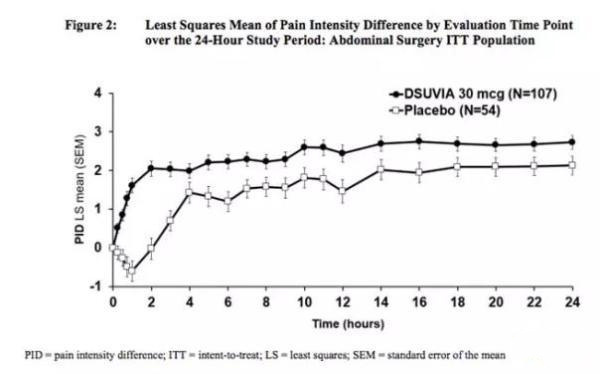
DSUVIA™ vs 安慰剂:DSUVIA™可显著改善急性疼痛患者前12h的疼痛强度(SPID12),具有统计学差异,明显临床收益。
具体请参考(Study SAP301, NCT#02356588)
二、FDA对阿片类药物审评审批的考量
DSUVIA™获批后,FDA局长Scott Gottlieb也发表一份声明,FDA局长简单评论DSUVIA™的审评,并指出FDA对与阿片类药物的审评审批考量。
局长谈DSUVIA™的批准,要点如下:
1. DSUVIA™提供了更为简单、便捷的给药方式
2. 药物开发同时获得美国国防部支持,相比注射剂,更适合军方使用
3. DSUVIA™销售、使用严格限制,同时上市后启动REMS
4. 黑框警告:滥用风险警告
以上4点中,1,2是该款药物能够获批上市的一个重要原因。
FDA对阿片类药物审评审批的考量
1. FDA正在建立阿片类镇痛药物收益/风险评估框架,新的评估框架将阿片类药物评估与整个公共健康相联系,从更为广泛的层面考量新的阿片类镇痛药物
2. 阿片类药物上市后滥用风险是药物审评的一个重要考量
3. 药物获批上市后REMS越来越重要
局长在第一次全员讲话中就明确指出:“阿片类药物滥用问题是一个巨大的挑战。”局长接管FDA以来,麻醉性镇痛药面临强力审查,2017年06月10号,FDA根据上市后研究,阿片类止痛药Opana ER(羟吗啡酮制剂)显著增加注射滥用事件,以非法滥用为由要求其主动撤市。阿片类药物在面临强力审查,上文中能够看出该类药物的审评将会愈加严格,药物的审评不再限于药物本身收益/风险,而将是评估药物能否满足现有阿片类药物无法满足的临床需求,能否降低镇痛药物滥用风险。
参考资料:
1、AcelRx announces FDA approval of DSUVIA™
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}