新发现:孤儿非编码RNA竟促进癌症转移
科学家们早就知道癌症能够劫持细胞现有的调节通路并将健康细胞转化为致命性的恶性肿瘤。然而,在一项新的研究中,来自美国加州大学旧金山分校的研究人员证实癌症并不仅仅是一个控制细胞管理操作的叛变者,它也是一个聪明的工程师,能够利用细胞中现有的原材料构建全新的促进疾病产生的调节网络。相关研究结果发表在2018年11月的Nature Medicine期刊上,论文标题为“Cancer cells exploit an orphan RNA to drive metastatic progression”。论文通讯作者为加州大学旧金山分校研究员Hani Goodarzi博士。论文第一作者为加州大学旧金山分校的Lisa Fish博士和Steven Zhang博士。
鉴定出候选小RNA分子
在研究小RNA(sRNA)---一类调节基因活性但不能编码功能性蛋白的RNA---时,这些研究人员鉴定出在癌细胞中观察到但在健康组织中基本上不存在的候选sRNA分子。更重要的是,这些sRNA分子是这个领域的科学家们之前从未观察到的或描述过的。他们将这些sRNA分子称为孤儿非编码RNA(orphan non-coding RNA, oncRNA)。
为了确保oncRNA真正是癌症特有的而不是实验性人工产物,这些研究人员对三种类型的乳腺癌进行了系统性搜索。他们确定了201个在癌症中存在但在正常的乳腺细胞中不存在的oncRNA。
oncRNA促进癌症转移
在这201个oncRNA中,其中的一个oncRNA特别突出---一个仅长45个碱基的oncRNA,它在高度转移性的乳腺癌中大量存在,这些研究人员将它称为T3p。
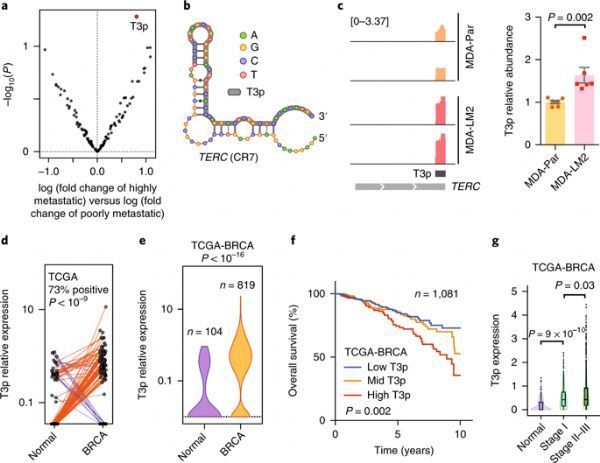
图片来自Nature Medicine, doi:10.1038/s41591-018-0230-4。
高水平的T3p与晚期乳腺癌和较低的患者存活率密切相关。但是这是为什么呢?T3p并不促进肿瘤生长。事实上,当这些研究人员让T3p失活时,癌细胞继续像以前一样生长和分裂。然而,让癌症变得致命性的关键不在于它的生长速率,而在于它是否高效地扩散,即是否高效地发生转移。
这些研究人员证实T3p是一种癌症转移加速踏板---它使得癌症更具侵袭性并加快它的扩散速度。在T3p不存在时,癌症侵入附近组织的能力明显减弱。此外,相比于接受具有活性T3p的癌细胞注射的小鼠,接受T3p已失活的癌细胞注射的小鼠具有更少的转移性肿瘤。
T3p的起源和功能
令人吃惊的是,这些研究人员发现T3p具有与TERC基因的3'端相同的序列,其中TERC基因编码细胞端粒酶中的RNA组分。端粒是在每条染色体的末端发现的重复DNA序列,保护染色体在细胞分裂时不会退化。端粒功能障碍参与多种与年龄相关的疾病和癌症。
T3p和TERC之间的序列相似性并非巧合。这些研究人员证实TERC是产生T3p的原材料。鉴于癌症中的基因活性失去调节,癌症会产生比预期更多的TERC RNA。这允许与RNA相互作用的特殊蛋白结合到过量的TERC上并切下它的3'端,从而产生T3p。
一旦从TERC中释放出来,T3p就会进入细胞的调节通路中,并在此过程中建立一个全新的调节网络。比如,在乳腺癌中,T3p与RISC相互作用,其中RISC是一种蛋白复合物,招募称为微小RNA(miRNA)的小RNA来抑制基因活性。T3p阻止RISC招募限制促转移基因(metastasis-promoting gene)NUPR1 和PANX2活性的miRNA,从而确保这些基因异常活跃并促进癌症持续进展。
流动的oncRNA
虽然oncRNA是在癌细胞中制造的,但它们不是俘虏。事实上,它们是漂泊者。这些研究人员发现oncRNA借助于外泌体(exosome)从癌细胞中逃逸出来,其中外泌体是微小囊泡,携带着RNA和蛋白等分子载物,以出芽的形式从癌细胞中释放出来,经常在血液中循环流通。他们能够从乳腺癌患者的血清中找到T3p和其他的oncRNA。
鉴于已知外来体在细胞之间转移分子载物,oncRNA可能被运送到不产生它们的细胞中,从而促进这些细胞发生转移。此外,外泌体中的oncRNA也可以作为一种强有力的新型诊断标志物,可在液体活检中检测到。
鉴于Goodarzi和他的团队在除T3p之外还鉴定了200个oncRNA,他们和其他的研究人员将有充分的机会进一步阐明这200个功能仍然是未知的oncRNA的生物学作用。
参考资料:
Lisa Fish, Steven Zhang, Johnny X. Yu et al. Cancer cells exploit an orphan RNA to drive metastatic progression. Nature Medicine, November 2018, 24(11):1743–1751, doi:10.1038/s41591-018-0230-4.
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}