《自然》:肠道微生物会“模仿”人体细胞交流信号,控制血糖代谢
人体肠道内存在数十万亿的细菌,这些细菌与人体细胞构成了“超级生物体”。作为“被忽略的人体器官”,它们对人体生长发育、生理代谢和免疫有着重要的作用。可是,细菌是一种原核生物,人体细胞是一种真核细胞,这两种生物差异巨大,究竟是以怎样的“语言”进行交流的呢?
近日,美国洛克菲勒大学和伊坎医学院研究人员给出了一个突破性的解释,肠道细菌分泌的一类小分子物质,可以模仿人体细胞之间交流过程中使用的化学语言,从而影响人体血糖代谢。原来肠道细菌作为“外国人”,一直在私底下默默模仿人体细胞“化学语言”,从而与人体细胞进行交流,并产生影响!
在发现了肠道细菌这个“秘密”后,研究人员尝试使用基因工程的方法改造大肠杆菌,使其产生类似内源性配体的小分子,进而改变人类新陈代谢并用来治疗某些疾病。小鼠相关实验表明,引入改良的肠道细菌能够成功降低血糖水平,并改善其它代谢变化。这一突破性的研究成果发表在上周《Nature》中[1]。
众所周知,许多分子可以传导细胞信号,如气味、光、蛋白质、多糖、脂质和氨基酸等,这些信号分子统称为配体,配体必须与其特异的受体结合才能发挥功能,而G蛋白偶联受体(G Protein Coupled Receptors, GPCRs)正是人体内最大的细胞膜表面受体家族,它几乎分布在所有的器官和组织内,通过与配体结合来激活细胞内的一系列信号通路,引起细胞状态的改变。GPCRs功能失调与许多危害人类健康的重大疾病密切相关,如癌症、心脏病、糖尿病、阿尔兹海默氏病、帕金森病等[2,3]。
2015年,该研究组的科学家曾在共生细菌中分离出小分子物质,发现其与人体内源性配体结构十分相似,而且体外培养实验证明,这种小分子物质能与GPCRs结合并发挥一定作用[4]。
因此科学家们猜测,共生细菌与人体细胞的“交流方式”可能就是通过“模仿”人内源性配体与GPCRs结合,从而影响人体健康。
为了验证这一假说,研究人员利用人类微生物计划(HMP)数据,发现胃肠道微生物中大多都含有合成该类小分子物质的酶的基因。
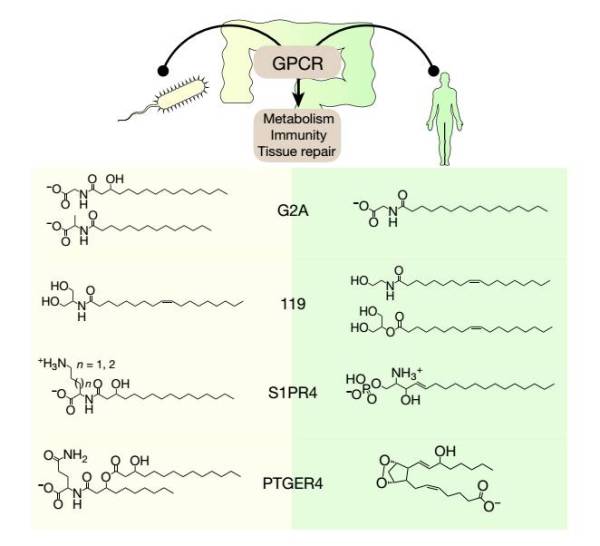 GPCR配体结构模拟。比较微生物编码和人体编码的GPCR配体提示结构和功能互补
GPCR配体结构模拟。比较微生物编码和人体编码的GPCR配体提示结构和功能互补
研究人员发现,这种酶产生的一种叫做N-酰基丝氨醇的物质和人体GPR119受体的内源性配体结构十分相似。GPR119受体是G蛋白偶联受体家族中的一员,之前有明确的证据表明,内源性配体与GPR119受体结合后,可使胰岛β细胞增殖,促进胰岛素分泌,延迟胃排空,降低血糖的同时抑制食欲,减轻体重。GPR119受体也成为近年来发现治疗糖尿病的重要靶标。
那么,胃肠道细菌分泌的N-酰基丝氨醇,能否发挥与GPR119内源性配体相同的作用呢?
研究人员通过“工程化”大肠杆菌,使其合成N-酰基丝氨醇(这是肠道细菌产生的可激活GPR119受体的“嫌疑人”小分子物质)合酶基因,并将其定殖在实验组无菌小鼠体内。将小鼠暴露于诱导剂IPTG(诱导外源基因表达)一周后,口服葡萄糖耐量试验(OGTT)结果显示,与对照组相比,30分钟后实验组小鼠血糖水平得到显著控制。
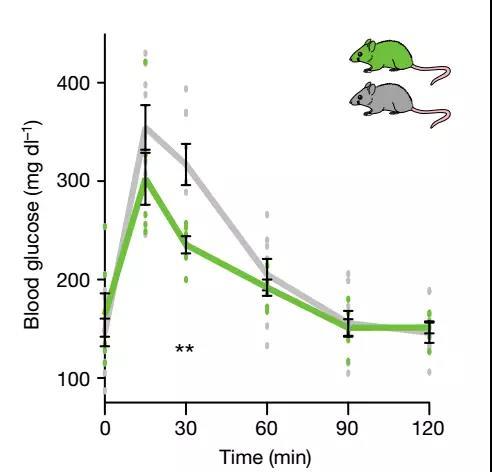 口服葡萄糖耐量试验30分钟后,与对照组相比,实验组小鼠血糖水平得到显著控制
口服葡萄糖耐量试验30分钟后,与对照组相比,实验组小鼠血糖水平得到显著控制
进一步研究发现,与对照组相比,定殖“工程化”大肠杆菌的实验组小鼠中,胰高血糖素样肽(GLP-1)和胰岛素浓度显著增加,这一现象与GPR119受体激动剂(治疗糖尿病药物)的效果相似。
因此,研究证实,通过胃肠道细菌衍生的配体类似小分子确实能与小鼠的GPR119受体结合,发挥与内源性配体相同的作用。这个结果也意味着,通过“工程化”改造胃肠道细菌产生相关配体小分子,以调节G蛋白偶联受体,是一种治疗代谢性疾病的潜在方法。
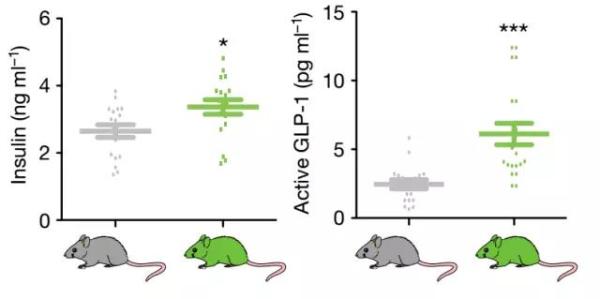 葡萄糖喂填后,与对照组相比,实验组小鼠GLP-1和胰岛素水平显著增加
葡萄糖喂填后,与对照组相比,实验组小鼠GLP-1和胰岛素水平显著增加
本文的通讯作者、美国洛克菲勒大学基因编码小分子实验室主任Sean Brady表示,许多G蛋白偶联受体都与代谢性疾病有关,因此它也是药物治疗广泛的靶点。胃肠道细菌与人体相互作用出现功能障碍,可能是代谢紊乱疾病(如炎症性肠炎或糖尿病)的发病机制。那么“工程化”胃肠道细菌将有助于治疗这些代谢性疾病。
Brady博士同时还说:“过去20年里,我们认识到人体与肠道细菌并不是对立存在的,它们是人体生理的一部分。而我们要做的就是调控肠道细菌,使它们有利于人体健康,我们希望能够更大规模地了解细菌产生的小分子及其发挥的作用,这项研究仅仅是第一步,未来我们的计划是系统地扩展和定义肠道细菌与人体细胞相互作用的化学物质。事实证明,我们的肠道使得这一计划充满了希望!”
参考资料:
[1]Cohen, L.J., et al., Commensal bacteria make GPCR ligands that mimic human signalling molecules. Nature, 2017.
[2]Cani P D, Plovier H, Van Hul M, et al. Endocannabinoids--at the crossroads between the gut microbiota and host metabolism[J]. Nature reviews. Endocrinology, 2016, 12(3): 133.
[3]Pacher P, Kunos G. Modulating the endocannabinoid system in human health and disease–successes and failures[J]. The FEBS journal, 2013, 280(9): 1918-1943.
[4]Cohen, L.J., et al., Functional metagenomic discovery of bacterial effectors in the human microbiome and isolation of commendamide, a GPCR G2A/132 agonist. Proc Natl Acad Sci U S A, 2015. 112(35): p. E4825-34.


{replyUser1} 回复 {replyUser2}:{content}